Estequiometria y equilibrio, parte I
Primero afrontaremos este tipo de problemas en los que no intervienen constantes, son ejercicios típicos de estequiometria en los que se calculan cantidades de sustancia ya sea en términos relativos (molaridades) o en términos absolutos ya sea en moles o en gramos u otras unidades de medida de masa.
Consideremos entonces la metanación catalítica

Enunciado del problema:
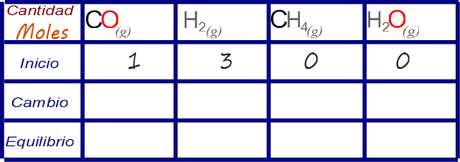
En un reactor de 10 litros se encuentra una mezcla inicial de reacción para metanación catalítica consistente en 1 mol de monóxido de carbono y 3 moles de hidrogeno molecular gaseoso y se inicia la reacción a una temperatura de 927°C con los adecuados catalizadores. Una vez que la reacción alcanzó el equilibrio se determinó que la masa de agua era de 0.387 moles. ¿Cuál es la composición molar de la mezcla de la reacción una vez alcanza el equilibrio?
Análisis de la pregunta:
La pregunta está dada en términos de composición molar y no en términos de concentración molar, lo cual implica que el resultado debe ser expresado en términos de moles.
Otro aspecto importante es que la respuesta deberá darse en términos de las cuatro especies y no de una sola, pues el equilibrio afecta las concentraciones de todas las especies químicas en la mezcla de la reacción.
Análisis del enunciado y tipo de problema:
Los términos en los que está planteado el problema son fáciles, y de hecho se lo podría plantear de una manera mucho más compleja. Por ejemplo los reactivos al ser gases se los podría expresar en términos de presiones parciales, y en tal caso se requeriría emplear las ecuaciones de los gases (generalmente la ley de los gases ideales es la que se emplea en los ejercicios de lápiz y papel, pero a nivel de ingeniería se emplean diversas leyes de gases reales) para calcular la cantidad de moles de reactivos.
En cuanto a los productos, estos también podrían ser pedidos en términos de presiones parciales, o más aun en términos de cantidades absolutas en unidades de masa como kilogramos.
Estas modificaciones adicionan complejidad aritmética al problema y de hecho no tienen nada que ver con el problema químico del ejercicio, sin embargo todos estos detalles pueden afectar el análisis del problema. Se aconseja analizar el problema primero ubicando el corazón químico y luego dibujando una ruta de cálculos.
Estrategia de análisis:
Este es un problema de cantidades, la respuesta se expresa en moles, esto implica que el valor del volumen del reactor es un distractor. Las condiciones termodinámicas como la temperatura permanecen constantes, lo cual implica que el valor para la temperatura del reactor en el enunciado también es un distractor.
Al ser un problema estequimétrico es necesario tener la ecuación química balanceada, es decir cumpliendo la ley de la conservación de la materia para reacciones no-nucleares.
Una vez esto claro, se realiza un análisis entre mole que se producen y moles que se consumen. Estequimétricamente se debe seleccionar aquella especie que se relacione con las demás de la manera más simple “la que tenga el menor coeficiente estequimétrico “la que tenga menos moles en la reacción balanceada””.
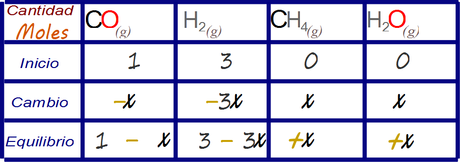
La estrategia de análisis recomendada para este tipo de ejercicio es mediante la legendaria tabla de cambios.
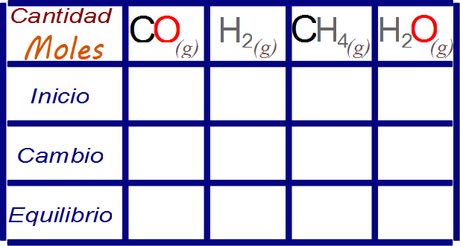
Primero llenamos las celdas cuyos valores se nos han informado en el enunciado y que NO son distractores.
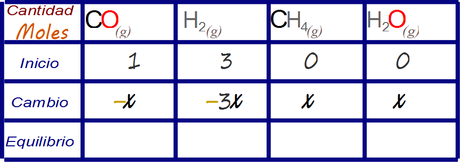
Luego adicionamos valores desconocidos x a las celdas vacías de acuerdo al análisis estequimétrico propuesto. Se le da el valor desconocido x a la especie química que se relaciona con menores valores de coeficiente estequimétrico en la reacción balanceada y se lo escribe en su relación con las otras especies químicas en las demás celdas, esto nos llena la fila correspondiente al cambio.
Finalmente plateamos las cantidades que deberían emerger en el equilibrio empleando el valor desconocido x.
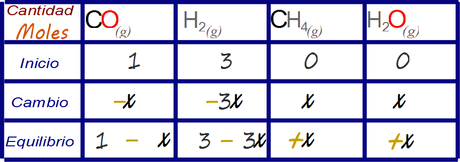
Con esto terminamos de plantear el problema de manera analítica, esta tabla puede resolver el problema para cualquier condición termodinámica de equilibrio siempre y cuando el valor x sea conocido, es por decirlo así la solución general.
Al igual que en los ejercicios de física llegar a la solución general es el primer objetivo que debe trazarse en la resolución de un ejercicio de lápiz y papel. Este objetivo debe separarse del segundo objetivo que es el cálculo de las cantidades específicas que plantea el ejercicio. Este orden propuesto permite evitar errores, especialmente con respecto al despeje de las unidades cuando es necesario.
Solución aritmética-algebraica
La tabla de cambios llena no es otra cosa que una matriz de ecuaciones matemáticas, el paso final y específico para el problema es reemplazar x con su valor específico donde corresponda y obtener los valores para la fila de equilibrio en la tabla de cambios.
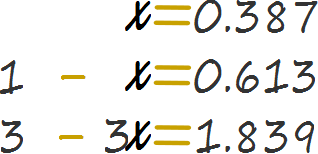
Por lo tanto, la respuesta es que en equilibrio existen 0.613 moles de monóxido de carbono, 0.613 moles de hidrógeno molecular gaseoso, 0.387 moles de agua y 0.387 moles de metano. PRINCIPAL REGRESAR
