 Respiración celular
aeróbica, la mitocondria y las bacterias aeróbicas
La respiración
celular aeróbica
Síntesis de ATP por
parte de la mitocondria
Maquinaria para la
síntesis de ATP
Estructura de la
proteína de síntesis de ATP
Formación de ATP
Respiración celular
aeróbica, la mitocondria y las bacterias aeróbicas
La respiración
celular aeróbica
Síntesis de ATP por
parte de la mitocondria
Maquinaria para la
síntesis de ATP
Estructura de la
proteína de síntesis de ATP
Formación de ATP
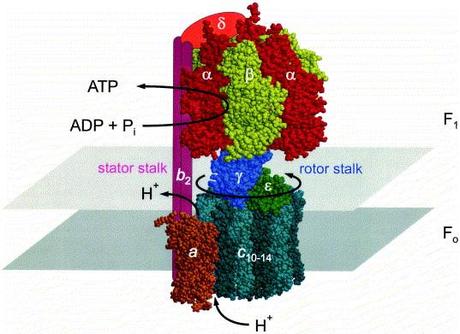
Estructura de la ATP sintetasa
La proteína que se encarga de la síntesis de ATP es compleja, y posee varios dominios integrados, donde el f1 es solo una parte de la historia.
Las proteínas de síntesis de ATP que generalmente reciben el nombre de ATP sintetasa son proteínas con forma de sobrero de hongo, compuesto por dos componentes básicos:
La cabeza esférica o componente f1 y una sección basal llamada f0 que se encuentra insertada en la membrana celular. Las dos secciones se encuentran conectadas por un conector o eje central. Una mitocondria de un hígado de un mamífero típico contiene alrededor de 15 000 copias de la proteína f1f0 ATP sintetasa.
Versiones homologas de la ATP sintetasa es encontrada en la membrana plasmática de las bacterias, los tilacoides de los cloroplastos y cianobacterias.
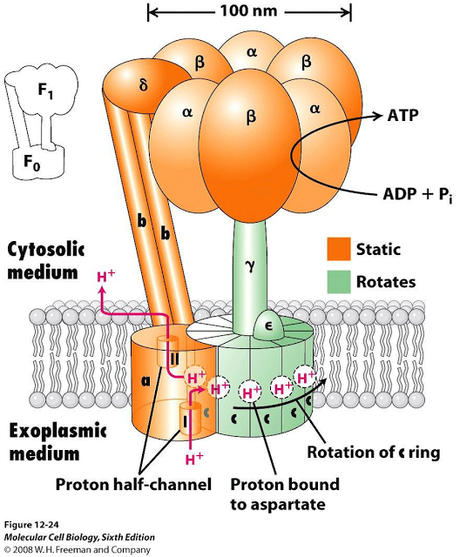
Figura EAS-01. Dos partes del complejo se diferencian como f1 y f0. La f0 "verde" es la estructura que rota realmente junto con el eje gama, mientras que f1 se queda estática con respecto a f0.
Las porciones f1 de la ATP sintetasa, ya sea de una bacteria o de una mitocondria contienen 5 diferentes tipos de polipéptidos. Los polipéptidos se denominan de acuerdo a letras del alfabeto griego, alfa (3 copias), beta (tres copias), delta, gamma y eta.Las subunidades alfa y beta se organizan de manera intercalada en la cabeza F1 de una manera semejante a los segmentos de una naranja o mandarina. Existen dos aspectos que deben tomarse en cuenta para futuras discusiones.
En primera instancia, cada cabeza f1 posee 3 dominios catalíticos, cada uno con la capacidad de sintetizar (o de cortar) una molécula de ATP ubicados en las subunidades beta.
En segunda instancia, la subunidad gamma sirve como eje central al cual se ancla la sección de f1 y se extiende hasta la base f0. En las versiones mitocondriales, todas las subunidades se sintetizan en el ADN del núcleo, se sintetizan en el citoplasma y luego importadas a las mitocondrias.
La sección f0 de la ATP sintetasa reside en el interior de la membrana y consisten en tres polipéptidos diferentes. Una subunidad a; dos subunidades b; y entre diez a catorce subunidades c. Se dice que entre diez a catorce debido a que el análisis comparativo ha demostrado que la cantidad de subunidades c puede cambiar dependiendo de la fuente de la que se extrae la enzima analizada.
Por ejemplo, tanto las levaduras como las bacterias E. coli poseen una ATP sintetasa que poseen ambas 10 subunidades c, mientras que la enzima de un cloroplasto posee 14 subunidades c.
La sección f0 contiene un canal de protones “permite el paso facilitado de iones hidronio” que conecta los dos lados separados por una membrana biológica.
La f1f0 ATP sintetasa puede funcionar por lo tanto como un canal de iones hidronio, dependiendo de las condiciones de equilibrio osmótico funcionará alternativamente como una bomba de protones de transporte activo consumiendo ATP, o como un canal de transporte pasivo facilitado con la producción de ATP en el proceso.
PRINCIPAL REGRESAR
