 Estructura de la clorofila
Estructura de la clorofila
Existen dos clases de clorofila, la clorofila a y la clorofila b, ambos son pigmentos verdes que absorben longitudes de onda especialmente en el azul y el rojo.
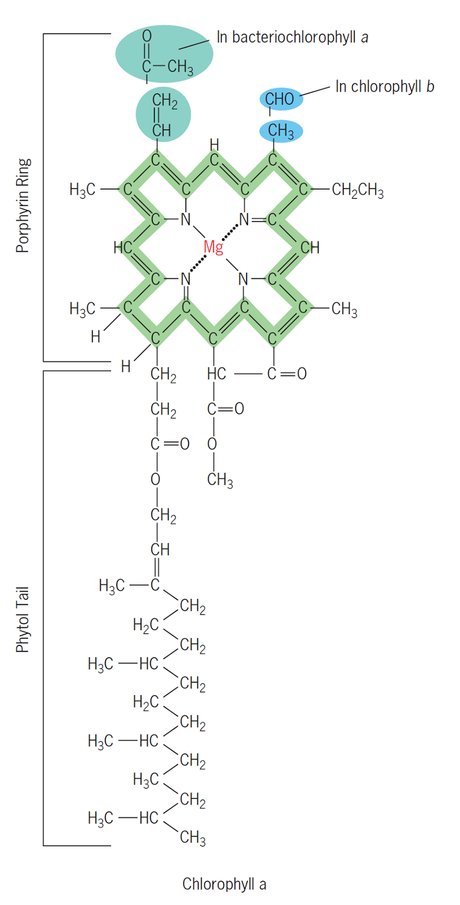
Figura EC-01. Estructura general de la clorofila. En verde el anillo de porfirina con su centro de magnesio. Sin color la cola. En el anillo de porfirina se señalan algunas diferencias entre diferentes clorofilas. En la esquina superior izquierda, se muestra que un grupo etil se reemplaza por un grupo metilcarbonil "forma una punta cetona" en el caso de las clorofilas de la clorofila de las bacterias verdes sulfurosas y parientes fotosintéticos. En la esquina superior derecha, se muestra que la diferencia entre la clorofila a y la b es el reemplazo de un grupo metil en la clorofila a por un grupo carbonil en la b generando una punta aldehído.
La estructura molecular es muy similar en la mayor parte excepto por una pequeña diferencia en un cambio de un grupo metil (clorofila a) por un grupo carbonil terminal (clorofila b), lo cual altera las longitudes de onda a las que responde la molécula. El resto de la estructura es similar.La clorofila a es una molécula de dos partes. La primer parte es un anillo de porfirina, que funciona como la parte de absorción de luz. Este anillo se encuentra en el interior de la membrana celular.
La estructura recuerda a la del grupo hemo, siendo un marco orgánico que apoya la función de un metal. En la hemoglobina es un átomo de hierro, mientras que en la porfirina es un átomo de magnesio.
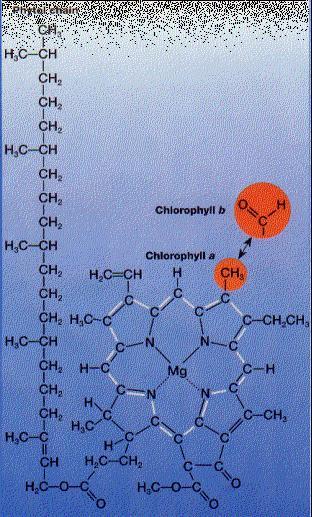
Figura EC-02. Estructura de la clorofila señalando los átomos diferentes entre la clorofila a y la clorofila b. Existen otros tipos de clorofila en algas pardas como la clorofila c y la clorofila d.
El anillo de porfirina posee una propiedad similar a la del anillo del benceno, sus enlaces dobles y simples alternantes no son más que una representación del enlace deslocalizado en donde los electrones fluyen de manera poco unida a sus respectivos núcleos.Cuando un fotón de luz impacta contra el anillo de porfirina, se causa una redistribución de la densidad de electrones, los cuales al estar deslocalizados, hace que se pierdan los electrones muy fácilmente. En otras palabras, la forma en como está unido el anillo de porfirina hace que los electrones de los enlaces dobles y simples sean fáciles de arrancar, y solo basta la energía contenida en un fotón de luz para lograr ese cometido.
El anillo de porfirina vibra con los fotones de algunas longitudes de onda, mientras que otras simplemente pasan sin activar el sistema de emisión de electrones.
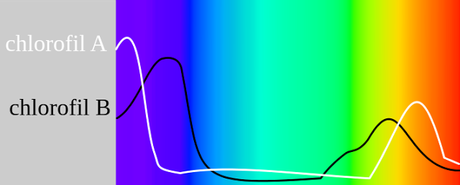
Figura EC-03. Diferencias en la absorción de luz entre las clorofilas a y b. Aunque ambas tienen picos de absorción hacia los mismos colores "azul y rojo" no se sobrelapan completamente, permitiendo absorber mas gamas de ambos colores. Cabe anotar que otra diferencia entre ambas clorofilas en las plantas terrestres es que se asocian a un fotosistema específico.
Este detalle es particularmente evidente en un espectro de absorción de absorción de luz para la molécula de clorofila. Al igual que cuando se hace para la fase gaseosa de ciertos elementos purificados, el espectro de absorción es único, y permite identificar la molécula. Sin embargo, ciertos polipéptidos cortos unidos de manera débil a la clorofila pueden modificar el espectro de absorción de luz. PRINCIPAL REGRESAR
