 Estructura molecular de la fuerza de los ácidos
Efecto de la densidad electrónica en la fuerza de los ácidos
Fuerza de enlace y la fuerza de los ácidos binarios
Fuerza de enlace y la fuerza de los ácidos oxácidos
La estructura y la fuerza de los ácidos polipróticos
Fuerza de enlace y
la fuerza de los ácidos binarios
Estructura molecular de la fuerza de los ácidos
Efecto de la densidad electrónica en la fuerza de los ácidos
Fuerza de enlace y la fuerza de los ácidos binarios
Fuerza de enlace y la fuerza de los ácidos oxácidos
La estructura y la fuerza de los ácidos polipróticos
Fuerza de enlace y
la fuerza de los ácidos binarios
Otro de los aspectos que afectan a la fuerza de los ácidos es el radio atómico del átomo que sirve como núcleo del ácido, si se considera a los halógenos “flúor, cloro, bromo y yodo se entiende que el volumen atómico aumenta de arriba hacia abajo, donde el flúor es el más pequeño y el yodo el más grande.
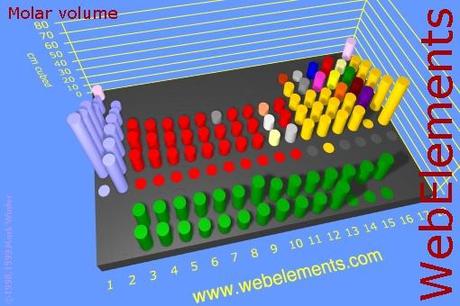
Figura FEF-01. Volumen de los respectivos elementos, el volumen se incrementa de arriba hacia abajo en la tabla periódica.
Experimentalmente se ha determinado que los ácidos más fuertes son aquellos a los que los protones se encuentran unidos a un elemento con un volumen más grande.De esta manera el más fuerte de los ácidos binarios de los halógenos es el yodo y el más débil el del flúor.
Eso para las columnas, cuando se analiza las filas el tamaño del átomo no afecta tanto la fuerza de los ácidos, pero otra propiedad periódica se vuelve importante y es la electronegatividad.
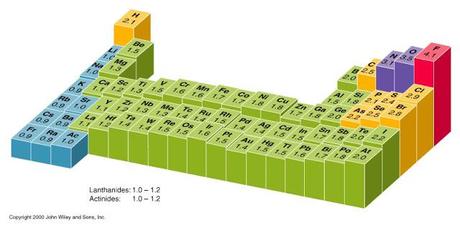
Figura FEF-02. Electronegatividad de los elementos con respecto a la tabla periódica.
Si el átomo central del ácido binario es más electronegativo, la fuerza del ácido aumenta. De esta manera si se compara al ácido fluorhídrico con el ácido oxhídrico “agua”, el primero es un ácido más fuerte que el segundo puesto que el flúor es más electronegativo que el primero. PRINCIPAL REGRESAR
