 La fuerza de los
ácidos y las bases
Fuerza relativa de
los ácidos y las bases
Determinando la
fuerza de un ácido de manera comparativa
Determinando la
fuerza de una base de manera comparativa
Estructura molecular
de la fuerza de los ácidos
Fuerza relativa de los
ácidos y las bases
La fuerza de los
ácidos y las bases
Fuerza relativa de
los ácidos y las bases
Determinando la
fuerza de un ácido de manera comparativa
Determinando la
fuerza de una base de manera comparativa
Estructura molecular
de la fuerza de los ácidos
Fuerza relativa de los
ácidos y las bases
En el artículo de “Pares acido-base conjugada” intriodujimos una serie de conceptos con respecto a la fuerza de los ácidos, pero en esta sección la ampliaremos lo más posible.
Recordemos que en base a la teoría de Bronsted-Lowry el ácido es un concepto que depende de la transferencia de protones “en la de Arrhenius se debía formar el ion hidronio, pero en la de Bronsted-Lowry pueden existir otros aceptores del protón”.
En base a lo anterior se puede concebir a las reacciones acido base como una competencia de las bases por ver quién puede aceptar protones de manera más eficiente “termodinámicamente favorable”
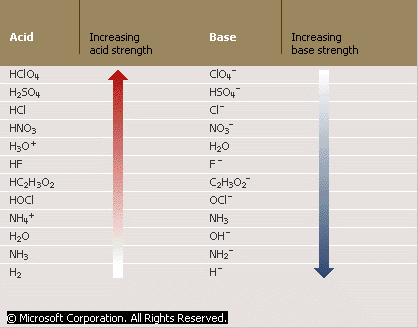
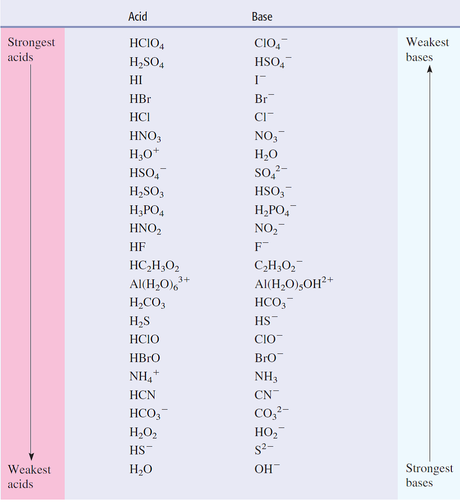
De esta forma los ácidos pueden ser organizados por su tendencia relativa “comparación entre otras especies químicas en ausencia de una escala absoluta” a ceder sus protones. Los ácidos más fuertes son aquellos que pierden sus protones más fácilmente que otros ácidos. De manera simultánea una base más fuerte es aquella que acepta protones de una manera más sencilla.
Mediante la comparación de múltiples ácidos se han construido diversas tablas en las que se describe pares de ácido-base conjugada que muestran la fuerza relativa de las especies en sus dos formas. Como ya se dijo anteriormente un ácido fuerte tiene una base conjugada débil.
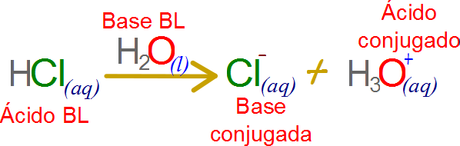
En las bases muy débiles, o ácidos muy débiles la reacción inversa ocurre en una frecuencia despreciable. Por ejemplo para el caso de la reacción anterior, la base conjugada del ácido clorhídrico que teóricamente puede recibir un portón de vuelta del ion hidronio, en la práctica lo hace en valores tan extremadamente bajos que en muchos casos no pueden ser medibles.
La reacción también puede ser descrita en términos de velocidades, los ácidos Fuertes desprenden sus protones a mayor velocidad que los ácidos débiles, por eso aunque se estén danto ambas reacciones, el equilibrio siempre tiende a que el cloro esté sin protón y el agua esté con su protón extra.
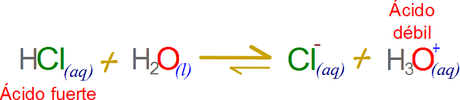
Es importante resaltar “nuevamente” que la fuerza de los ácidos es relativa, por ejemplo el ácido clorhídrico es fuerte en comparación al ión hidronio, pero a su vez el ion hidronio es un ácido más fuerte que otras especies químicas.
Una reacción de ácido base en la teoría de Bronsted-Lowry apunta generalmente en la dirección del ácido más débil. PRINCIPAL REGRESAR
