Hola descubridoras y descubridores de la química,
Os voy contar la historia de la química, algo que hacía tiempo que tenía ganas de hacer, pero aprovechando que tengo que conocerla para una asignatura del máster hago este hilo que a mi me sirve también para repasar.
En primer lugar, os voy a mostrar cuál será la estructura que emplearé para contaros la historia de la química:
-La antigüedad.
-De la Edad Media al Renacimiento.
-La Edad Moderna.
-Química del siglo XIX y la industria química.
-Clasificación de los elementos químicos.
-Modelos atómicos.
Aunque voy a intentar ir al grano, es posible que este hilo me quede un poco largo, ya que vamos a pasar por muchas etapas históricas.
Los seres humanos siempre estuvieron rodeados de fenómenos científicos, pero fue en la antigüedad cuando el hombre consiguió dominar el fuego, que empezó a ser posible la capacidad de producir cambios químicos de forma deliberada. Lo que permitió cocinar y moldear materiales como huesos y metales.

Se atribuía una relación entre la química y la magia, ya que existía el mito de que el fuego fue robado a los dioses por Prometeo.
Pero también es importante el carácter práctico de esta ciencia, el cual tuvo un gran auge en el Egipto faraónico donde se comenzaron a fabricar papiros y vidrios, y a experimentar con la cal y la sosa.

En la Antigua Grecia, 600 años antes de Cristo se inició el pensamiento científico, empezaron a plantearse cuestiones tales como la naturaleza del universo y la estructura de la materia.
Algunos filósofos destacables de la Antigua Grecia son: Tales de Mileto, Leucipo, Empéclodes, Platón o Aristóteles (con quien termina el periodo clásico de la filosofía griega).
Posteriormente, tuvieron lugar las Conquistas de Alejandro Magno, y comienza el período helenístico. Del cual dos pensadores importantes fueron Arquímedes y Nerón de Alejandría.

Durante el período helenístico nació la alquimia, llamada por los griegos “Khemeia”.

Durante la Edad Media la alquimia penetró en Europa gracias a los árabes, que la llamaron “Al-Kimiya”.
Los alquimistas importantes de este período árabe fueron Geber y Avicena.
Geber descubrió la destilación del vinagre para obtener ácido acético fuerte, la preparación de ácido nítrico y la teoría de que todos los metales están compuestos por azufre y mercurio, siendo posible su transmutación en oro con el uso de la misteriosa sustancia denominada el “Elixir de la vida”.
Este “Elixir de la vida” lo denominaban como piedra filosofal, los alquimistas buscaban la piedra filosofal. Es posible que os estéis acordando de la primera película de Harry Potter y lo cierto es que la base teórica en la que está sustentada es esa.

Avicena publicó la obra conocida como “El canon de medicina”.

Durante los siglos XI y XV en Europa los principales personajes fueron Alberto Magno (considerado actualmente el patrón de los químicos) quien hizo una descripción detallada sobre el arsénico y Roger Bacon quien realizó la primera descripción para la fabricación de la pólvora.
Durante el Renacimiento se aplicaron los conocimientos de la alquimia a la obtención de medicamentos y al avance de la química técnica, desechando sus aspectos más esotéricos. Siendo Paracelso uno de los químicos más destacados que se ocupó de la preparación de medicinas para el tratamiento de enfermedades.
Antes de avanzar, es importante aclarar que la alquimia fue recibida en Europa con una mezcla de admiración y rechazo. Admiración por la utilidad de conocimientos que permitían la manipulación de los materiales y, a su vez, rechazo porque esto podía influír en lo espiritual.
Esta parte mística de la alquimia es lo que hizo que la química como ciencia no se desarrollase hasta mucho después.
Dejamos atrás la Edad Media y el Renacimiento y nos metemos en la Edad Moderna, periodo en el que tiene lugar la separación de lo espiritual y lo material, y cada vez hay un mayor interés por los resultados prácticos.
El fin de la alquímica y el comienzo de la química llegó con Robert Boyle, con la publicación de su obra “El químico escéptico”.

Boyle buscaba el explicar el funcionamiento de las reacciones químicas y del mundo como una gran obra de relojería, dejando atrás los antiguos conceptos aristotélicos.
Las principales aportaciones de Boyle y otros científicos acerca de los gases y su comportamiento supusieron un gran avance. Además, fue imprescindible el uso de nuevos instrumentos como la balanza, la trampa de gases o la pila de Volta.
Lavoisier (siglo XVIII) es considerado el padre de la química moderna, ya que desmintió la teoría del flogisto, una teoría que apareció a principios del siglo XVIII haciendo que la química tomase una dirección equivocada ya que carecía de base científica.
Sus investigaciones llevaron al desarrollo de: La ley de las proporciones equivalentes, la ley de las proporciones definidas, la ley de las proporciones múltiples y la propuesta por Dalton de los primeros símbolos para los elementos químicos.
En el siglo XIX la química era ya una ciencia cuantitativa de gran importancia para la industria y la sociedad por su capacidad explicativa y el valor comercial de los productos que sintetizaba, desarrollándose con ella la creación de industrias químicas.
La industria química a pesar de los grandes beneficios que aportaba no estaba bien considerada socialmente por la carencia de conciencia medioambiental en las infraestructuras, aunque en la actualidad este aspecto ha mejorado notablemente.
A partir del trabajo de John Dalton se fue consolidando la visión atómica de la materia, desarrollándose una nueva forma de pensar en términos de masas atómicas.
Berzelius realizó aportaciones cruciales en este terreno como el descubrimiento del cerio, el silicio, el selenio y el torio.
En este siglo también fueron culminantes los nuevos descubrimientos en electricidad. Alejandro Volta consiguió obtener electricidad a través de una reacción química.

Se había aceptado el concepto de átomo de Dalton, sin embargo, no se había contestado a la pregunta ¿Cómo se combinan los átomos? Fue Amadeo Avogadro en 1911 quién contestó a esta pregunta y planteó la conocida hipótesis de Avogadro.
Canizarro y colaboradores a partir de la hipótesis de Avogadro publicaron un listado de masas atómicas y moleculares. Esta unificación de las masas atómicas fue un impulso a la tan deseada clasificación de los elementos.
Ahora, vamos a pasar al apartado de clasificación de los elementos químicos, que desarrollaré muy por encima.
Los griegos (Aristóteles) establecieron que la naturaleza estaba compuesta por cuatro elementos que componen la naturaleza: agua, fuego, aire y tierra. Siendo el éter el quinto elemento que lo constituía, lo que hoy entendemos como el vacío.
En 1864 Newlands dispuso los elementos en orden creciente de pesos atómicos, publicando así su “Ley de octavas”.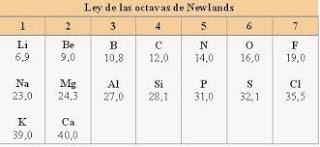
Posteriormente Beguyer de Chancourtois realizó una ordenación basada en pesos atómicos crecientes en una forma cilíndrica.

En la siguiente imagen, os muestro el documento original con la tabla periódica de Mendeleiév que parece una hoja de unos apuntes en sucio.

Pero cuando se publicó, como podéis observar, era bastante más presentable. Si queréis podéis comprobar que efectivamente donde dejó un hueco ahí habría un elemento.
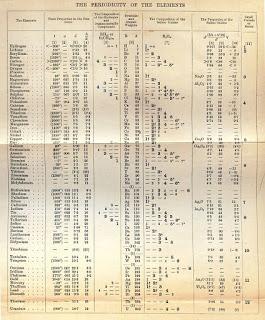
Sin embargo, en la tabla periódica de Mendeleiév había contradicciones en los pesos atómicos y propiedades. En 1912 Moseley con el descubrimiento de los rayos X pudo establecer que el número atómico es igual al número de cargas eléctricas del núcleo.

En 1954 Werner y Paneth establecieron la tabla periódica actual en la que los elementos están ordenados según la carga nuclear, que ha ido sufriendo modificaciones hasta el día de hoy.
Para finalizar este pedazo hilo, me gustaría comentar algunos aspectos históricos sobre los modelos atómicos.
Demócrito (460 – 370 a. C) se considera el fundador del atomismo y, para el todo está compuesto por átomos, los átomos se consideran indivisibles.
22 siglos después John Dalton recogió la idea de Demócrito del átomo y publicó un modelo atómico basado en que la materia estaba formada por átomos y que podía ganar o perder cargas.
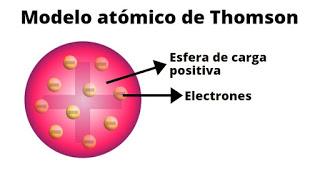
Más adelante, Joseph John Thomson, quien descubrió el electrón propuso el Modelo atómico de Thomson, el famoso “Buding de pasas”.
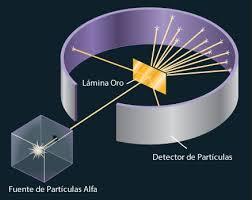
Más adelante se realizó el “experimento de la lámina de oro” en el que se concluyó que el átomo está formado por un núcleo (positivo) alrededor del cual orbitan los electrones. Y después se demostró que existen además los neutrones cuya función era la de estabilizar el núcleo.
Sin embargo, una serie de experiencias, fenómenos y leyes inexplicables mediante este modelo hicieron que tuviera que ser superado. La teoría electromagnética de Max Planck, la teoría cuántica, la dualidad onda-partícula de la luz, las rayas espectrales, etc movieron a Niels Böhr a publicar su modelo.
Según este los electrones se disponen alrededor del núcleo mediante capas de electrones de las cuáles las más externas son las responsables de las propiedades químicas del elemento. De manera análoga a las capas de una cebolla.

Esta es la base del modelo atómico actual, basado principalmente en los descubrimientos de Schrödinger y Heisenberg y en el desarrollo general de la mecánica cuántica.
Bueno esto es todo por hoy, espero que en este pedazo hilo os haya quedado clara la historia de la química. Como habréis podido observar es muy difícil contarla de una manera secuencial, por lo que a veces he ido de adelante para atrás.
Sobre todo en los siglos XIX-XXI ya que en esos siglos hay que contar por un lado el desarrollo de la industria química, la evolución del concepto átomo y los cambios en la tabla periódica. Estos dos últimos aspectos, como ya tengo comentado en otros hilos aunque se cuenten de una manera separada están relacionados.
Y con esta reflexión cierro esta entrada. Espero que os haya gustado.
Bibliografía:
-Historia de la química. (2020) En A. Palacios (Comp.), Máster en formación del profesorado de secundaria. Universidad Internacional de la Rioja.
-Elguero Bertolini, J.E., Goya Laza, P.,Roman Polo, P. (2019). La tabla periódica de los elementos químicos. Madrid, España: catarata.
-Gobierno de España. Ministerio de educación y formación profesional. Competencias Clave para el aprendizaje permanente. Recuperado de: https://www.educacionyfp.gob.es/dctm/ministerio/educacion/mecu/movilidadeuropa/competenciasclave.pdf?documentId=0901e72b80685fb1.
-Petrucci, R.H., Henrring F.G., Madura D.J., Bissonnette, C. (2011). Química general. Madrid, España: Pearson.
-Roman Polo, P. (2008). El profeta del orden químico. Mendeleiév. Madrid, España: nivola.
-Scerri,E.(2013).La tabla periódica: Una breve introducción. Madrid, España: Alianza.
15 de Febrero de 2021
Descubrir La Química. Graduada en Química por la Universidad de Santiago de Compostela. Estudiante del Máster en Formación del Profesorado.