La energía libre de Gibbs La energía libre y la segunda ley de la termodinámica Interpretación de la energía libre de Gibbs Energía libre estándar y sus cambios Aplicación de las variables termoquímicas ΔH, ΔS y ΔG Interpretación de la energía libre de Gibbs
La energía libre de Gibbs nos representa la energía que no es consumida por la temperatura o la entropía, es lo que ceda y por eso se la llama libre, libre para hacer cosas.
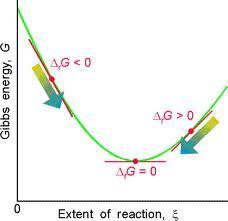
Es un potencial termodinámico, es decir, una función de estado extensiva con unidades de energía, que da la condición de equilibrio y de espontaneidad para una reacción química (a presión y temperatura constantes).
Nuevamente las condiciones de equilibrio y espobntaneidad dependen de los estados iniciales y finales de un sistema y siempre se grafican usando la analogía de la colina y la esfera.
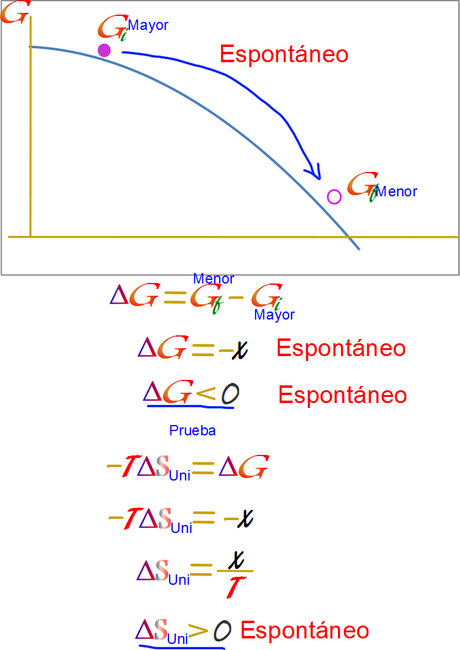
Calculos con la metáfora para el proceso espontáneo. En esta sumimos un sistema en lo alto de una colina, es decir con alta energía, la cual se desliza hacia abajo liberando energía de manera espontánea.
El segundo caso es tener una esfera en lo más bajo, la cual debe recibir energía o esfuerzo para llevarla al punto más alto de la colina.
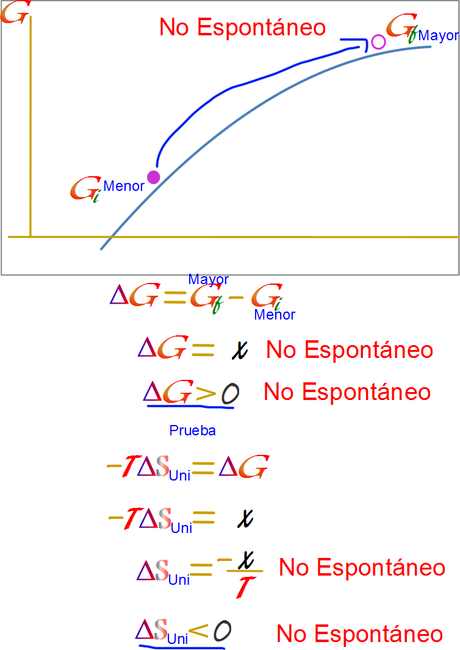
La analogía de la colina es ubicua en los cálculos termoquímicos, y esa es la razón de cambiar el signo a la entropía del universo, de lo contrario no se podría aplicar la analogía de la colina. PRINCIPAL REGRESAR
