El espectro electroforético (EEF) de las proteínas sanguíneas es una exploración de laboratorio solicitada frecuentemente por el médico de familia. En la actualidad, la técnica disponible para realizar el proteinograma es la electroforesis capilar, donde la muestra se hace pasar por un capilar y las proteínas se separan debido a un fuerte voltaje electroosmótico. La introducción de esta tecnología ha permitido aumentar la calidad del proteinograma y una mayor rapidez, comodidad y precisión. En este post se analiza la interpretación del EEF.
Su indicación más corriente es el estudio de un aumento de la velocidad de sedimentación globular o un aumento o disminución de la proteinemia. Permite confirmar estados inflamatorios o infecciosos, sospechar tumores y orienta los estudios posteriores. También es una exploración que resulta indispensable para el diagnostico y seguimiento de las gammapatías monoclonales.
La concentración media de proteínas séricas es de 65-80 g/l en el adulto y toda proteinemia inferior a 60 g/l o superior a 85 g/l debe explorarse mediante el EEF.
La movilidad de cada proteína en el proteinograma está vinculada a su carga eléctrica, distinguiéndose cinco fracciones:
- Albúmina: es la más importante de las proteínas séricas;
- Cuatro grupos de globulinas de migración α1, α2, β y ϒ que agrupan proteínas de funciones muy diferentes.
La electroforesis normal se representa en la figura 1 y sus valores normales se muestran en la tabla 1.
Figura 1.- Espectro electroforético con hipergammaglobulinemia policlonal.
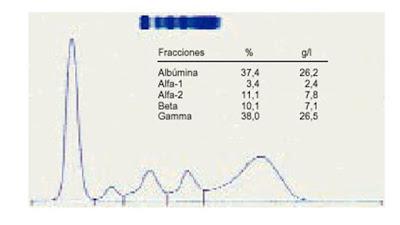
Tabla 1.- Valores normales del proteinograma.
Las principales α1-globulinas son: la α1-antitripsina (α1-AT) (2-4 g/l), la α-1-Glucoproteína ácida u orosomucoide (0,4-0,9 g/l) y la α 1-antiquimotripsina (0,3-0,6 g/l). Las principales α 2-globulinas son: la α 2-macroglobulina (2-3,5 g/l), la haptoglobina (0,6-1,8 g/l), la ceruloplasmina (0,25-0,43 g/l) y la α -lipoproteína. Las principales β-globulinas son: la transferrina (2-4 g/l), el complemento C3 (1-1,3 g/l) y la β-lipoproteína. Las principales ϒ-globulina son : IgG (8-18 g/l), IgA (0,9-4,5 g/l), IgM (0,6-2,5 g/l), IgD e IgE.
ALTERACIONES DE LA DE LA ALBÚMINA
La hiperalbuminemia no posee significado patológico; traduce una hemoconcentración o está en relación con una perfusión de albúmina.
La hipoalbuminemia puede ser:
- Mutación genética sin consecuencias patológicas.
- Tratamiento con b-lactamina que se fija a la albúmina y modifica su migración.
- Fístula pancreática: lisis intracavitaria de la albúmina por los enzimas pancreáticos.
Disminución de la síntesis
- Insuficiencia hepatocelular: cirrosis, hepatitis grave, inflamación.
- Desnutrición crónica grave.
- Urinaria: síndrome nefrótico.
- Digestiva: enteropatía exudativa.
- Cutánea: quemaduras.
ALTERACIONES DE LAS DE LAS α 1-GLOBULINAS
Aumento de la α 1-globulinas
El aumento de la α 1-globulinas sugiere Inflamación aguda o crónica, asociada a aumento de las α 2-globulinas.
Las concentraciones séricas de α-1-Glucoproteína ácida varían con el sexo y la edad.Se ha observado un aumento de los niveles durante los procesos inflamatorios agudos y crónicos.Los niveles aumentan tras el infarto de miocardio, neoplasias, enfermedades autoinmunitarias, quemaduras traumatismos, anomalías hematológicas, obesidad, insuficiencia renal y tras la administración de ciertos fármacos inductores de enzimas.
La α-fetoproteína es una proteína que normalmente sólo se produce en el feto durante su desarrollo. Cuando aparece en adultos, puede servir como un marcador tumoral. Si aparecen niveles elevados de α-fetoproteínaAFP en el líquido amniótico puede ser una indicación de un defecto en el desarrollo del feto (defectos del tubo neural, onfalocele, teratoma sacrococcígeo, etc.), debiéndose ofrecer consejo genético.
Como con todos los marcadores tumorales, la presencia de α-fetoproteína por sí misma no es un diagnóstico de nada, sin embargo es ciertamente recomendable el poder descartar las enfermedades que pueden incrementar sus niveles, siendo las causas más importantes que provocan un incremento de la α-fetoproteína en un adulto el carcinoma de células hepáticas (hepatocarcinoma), el carcinoma de células germinales del testículo y el cáncer de ovario, También se observan concentraciones elevadas de α-fetoproteína en otros cánceres (estómago, colon, pulmón, mama, linfoma). y en otros procesos como la cirrosis hepática, y la hepatitis activa, determinadas substancias tóxicas (drogas), pacientes afectados por ataxia telangiectasia,
La α-fetoproteína se utiliza fundamentalmente con finalidades de monitorización o seguimiento, la disminución de sus niveles indica una respuesta al tratamiento. Si las concentraciones después del tratamiento del cáncer no disminuyen de manera significativa (normalmente hasta niveles normales o próximos a la normalidad), puede pensarse que no se ha conseguido eliminar todas las células cancerosas.
Disminución de la α 1-globulinas
La disminución de la α1-globulinas se presenta en:
- Insuficiencia hepatocelular.
- Fuga proteica, asociada a disminución de la albúmina, de las α2 y β-globulina.
- Déficit de α 1-antitripsina (α1-AT): El déficit de α1-AT, proteasa sintetizada por el hígado, es una enfermedad genética. Cuando la electroforesis de las proteínas sanguíneas evidencia una disminución de α1-AT, es conveniente medir la concentración sérica de α1-AT mediante dosificación inmunoquímica y caracterizar el fenotipo. Existen varios fenotipos con forma heterocigótica PiMZ (2-4% de la población) y forma homocigótica PiZZ (0,02- 0,06% de la población). La forma heterocigótica se acompaña de una concentración sérica de α1-AT del 60% de la normalidad y la forma homocigótica, de una concentración sérica del 10% de la normalidad. Sólo los individuos homocigóticos pueden desarrollar sintomatología. La manifestación más frecuente son el enfisema del adulto joven, cirrosis, afectación pancreática y osteoporosis.
ALTERACIONES DE LAS α-2-GLOBULINAS
- Síndrome inflamatorio
- Síndrome nefrótico: por aumento de la α 2-macroglobulina
- Síndrome nefrótico: híper α2-globulinemia asociada a hipoalbuminemia por fuga urinaria, híper β-globulinemia por aumento de las β-lipoproteínas e hipo ϒ-globulinemia, en particular en la nefrosis lipídica
- Haptoglobina de fenotipo diferente, sin significado patológico: desdoblamiento.
- Insuficiencia hepatocelular
- Perdidas de proteinas
- Desnutrición
- Hemólisis: descenso de la haptoglobina
ALTERACIONES DE LAS DE LAS β GLOBULINAS
- La zona β aumentada en su conjunto y asociada a un bloque β- ϒ- globulinas traduce el aumento policlonal de las IgA observado en la cirrosis etílica.
- Hipertransferrinemia de las anemias ferropénicas.
- Aumento de la β-lipoproteína (ApoB).
- Gammapatía por IgA o IgM
- Cadenas ligeras de inmunoglobulinas del mieloma o de la amilosis (pico pequeño.)
- Insuficiencia hepatocelular.
- Desnutrición
- Perdida de proteinas
- Hipocomplementemia C3 por consumo
ALTERACIONES DE LAS ϒ-GLOBULINAS
Un estrecho pico de ϒ-globulinas (de modo más infrecuente, de β-globulinas o incluso de α 2-globulinas) corresponde a una inmunoglobulina monoclonal sintetizada en exceso. La electroforesis capilar permite, mediante una técnica de inmunosustracción, caracterizar la inmunoglobulina monoclonal: IgG, IgM, IgA o, de modo más infrecuente, IgD o IgE, sin embargo esta técnica es menos sensible que la inmunoelectroforesis o la inmunofijación.
La inmunoglobulina monoclonal se sintetiza por un clon de células B hiperestimulado en el curso de una gammapatía monoclonal de significado incierto (GMSI) o de un síndrome linfoproliferativo maligno. La etiología se distribuye de la siguiente forma:
- GMSI 65%.
- Mieloma 15%.
- Amilosis primaria 6%.
- Linfoma maligno no Hodgkin 6%.
- Leucemia linfoide crónica 3%.
- Enfermedad de Waldenström 3%.
- Plasmocitoma solitario 2%.
La exploración física deberá dirigirse a la búsqueda de afectación ósea, adenopatías o hepatoesplenomegalia. Por lo general unas exploraciones complementarias sencillas bastan para distinguir una GMSI de un síndrome linfoproliferativo (Tabla 2).
En la tabla 3 se resumen las exploraciones que deben solicitarse ante un paciente con un pico monoclonal.
La presencia de IgG o de IgA debe llevar a descartar sobre todo un mieloma; la presencia de IgM orienta más bien hacia la enfermedad de Waldenström o el linfoma; entonces se debe completar el estudio mediante tomografía computarizad abdominal en busca de adenopatías o de esplenomegalia.
El significado exacto de una GMSI resulta impreciso, pero con certeza se relaciona con un déficit de la inmunidad celular y/o un estímulo antigénico crónico. Así pues, las GMSI son más frecuentes en el paciente de edad avanzada (1% de la población de 60 años, 3% a los 70 años y 10% a los 80 años) y en determinados problemas de salud (Tabla 4).
VIH: virus de la inmunodeficiencia adquirida; CMV: citomegalovirus; VEB: virus de Epstein-Barr.
Si bien algunas GMSI son transitorias (especialmente en las infecciones), la mayoría pueden evolucionar hacia un síndrome linfoproliferativo: un 10% de transformación maligna a los 5 años y un 22% a los 20 años. Resulta pues indispensable el seguimiento regular permanente, 3 meses después del descubrimiento y luego cada 6 meses. Se basa en la exploración física y en estudios de laboratorio (electroforesis de las proteínas, hemograma, creatininemia, calcemia, proteinuria), que se completarán con un mielograma y radiografías óseas si existe signo de indicio.
Con poca frecuencia, la gammapatía puede ser biclonal (dos inmunoglobulinas distintas). El significado y la conducta que deben observarse son idénticos.
Las enfermedades de cadenas pesadas se caracterizan por la presencia en el suero de cadenas pesadas aisladas de inmunoglobulinas . La presencia de un pico en la electroforesis de las proteínas es inconstante, dada la baja concentración de proteína anómala (inferior a 1 g/l) y de la heterogeneidad de su carga eléctrica. Se trata de trastornos inmunoproliferativos infrecuentes, que se acompañan habitualmente de hipogammaglobulinemia y cuyo diagnóstico requiere inmunoelectroforesis. Se describen tres variedades.
- La enfermedad de cadenas pesadas α : la más frecuente, afecta a los individuos jóvenes. La infiltración linfoplasmocítica difusa del intestino delgado y de los ganglios mesentéricos es responsable de un síndrome de malabsorción grave. Su evolución es a veces favorable con antibióticos, pero no es raro que se presente un linfoma maligno inmunoblástico.
- La enfermedad de cadenas pesadas ϒ : afecta esencialmente a los individuos de edad avanzada. Su cuadro polimorfo es parecido al de la enfermedad de Waldenström.
- La enfermedad de cadenas pesadas µ: es la más rara. Su cuadro hace pensar en una leucemia linfoide crónica, pero el mielograma encuentra plasmocitos vacuolados.
Se trata del aumento de todas las inmunoglobulinas. Esta anomalía no posee un significado patológico preciso. Es fisiológica en los habitantes de los países tropicales y en los individuos que sufren malnutrición, por infecciones bacterianas y parasitarias de repetición. Su etiología es diversa (Tabla 5).
Es fisiológica en la infancia, puesto que la concentración de IgM adulta se alcanza hacia el primer año de edad, la concentración de IgG a los 6 años y a concentración de IgA en la pubertad.
En el adulto, es conveniente ante todo confirmar la hipogammaglobulinemia mediante la determinación ponderal de las inmunoglobulinas. La etiología puede ser, por orden decreciente de frecuencia, la siguiente: determinados fármacos, hemopatías linfoides, fugas de inmunoglobulinas y déficit congénitos de la inmunidad humoral (Tabla 6).
Tabla 6.- Etiologia Hipogammaglobulinemia
En el mieloma de cadenas ligeras, el exceso de cadenas ligeras Ϗ o λ puede producir a veces un pequeño pico en β o ϒ -globulinas pero, por lo general, la electroforesis de las proteínas sólo muestra hipogammaglobulinemia en relación con la represión de síntesis de las inmunoglobulinas normales. La inmunoelectroforesis o la inmunofijación encuentran la cadena ligera en la sangre, incluso en la orina. Mucho más infrecuentemente, puede tratarse de un mieloma no excretor. El diagnóstico se establecerá entonces mediante el estudio con inmunofluorescencia de los plasmocitos medulares.
Algunos déficit congénitos de la inmunidad humoral pueden manifestarse en la edad adulta. Se debe pensar en ellos ante infecciones bacterianas o por enterovirus de repetición; se acompañan a menudo de hiperplasia de los órganos linfoides, manifestaciones autoinmnes, malabsorción y linfomas, en particular digestivos.
Finalmente, hay que tener en cuenta que existen hipogammaglobulinemias transitorias en determinadas afecciones como virasis, neumopatías bacterianas y septicemias, y diabetes mellitus desequilibrada.
1.Amara S, Debuze BJ, Cooley T, Pantanowitz L, Aboulafia DM. HIVassociated monoclonal gammapathy: a retrospective analysis of 25 patients. Clin Infect Des 2006;43:1198-205.
2.Bergon E, Miranda I, Miravalles E. Blood protein electrophoresis, instrumentation. Clin Chem Lab Med 2005;43:721-3.
3.Bossuyt X, Lissoir B, Mariën G, Maisin D, Vunckx J, Blanckaert N, et al. Automated serum protein electrophoresis by capillarys. Clin Chem Lab Med 2003;41:704-10.
4.Bühler S, Laitinen K, Holthofer H, Jarvinen A, Schauman KO, Hedman K. High rate of monoclonal gammapathy among immunocompetent subjects with primary cytomegalovirus infection. Clin Infect Dis 2002;35:1430-3.
5.Chopra GS, Gupta PK, Mishra DK. Evaluation of suspected monoclonal gammapathies: experience in a tertiary care hospital. MJAFI 2006;62: 134-7.
6.Csako G, Costello R, Shamin EA, O'Hanlon T, Tran D, William HJ, et al. Serum proteins and paraproteins in women with silicone implants and connective tissue disease; a case-control study. Arthritis Res Ther 2007;9:271-9.
7.Fischer A. Les déficits immunitaires primitifs des lymphocytes B. Rev Prat Méd Gén 1991;9:790-4.
8.Le Carrer D. Électrophorèse et immunoélectrophorèse des protéines sériques. Paris: Hatier; 1994.
9.LemoineA, Pham P,Azoulay P, Saliba F, Emile JF, Saffroy R, et al. Detection of gammapathy by serum protein electrophoresis for predicting and managing therapy of lymphoproliferative disorder in 911 recipients of liver transplants. Blood 2001;98:1332-8.
10.Litwin CM, Anderson SK, Phillips G, Martin TB, Jaskowski TD, Hill HR. Comparison of capillary zone and immunosubstraction with agarose gel and immunofixation electrophoresis for detecting and identifying monoclonal gammapathies. Am J Clin Pathol 1999;112: 411-7.
11.Seligmann M. Maladies des chaînes lourdes. Rev Prat 1993;43:317-20.
12.Willemin B, Blickle JF, Brogard JM, Duchène M. Exploration de la réaction inflammatoire. Ann Med Interne (Paris) 1990;141:333-9.
13.Yang Z, Harrison K, Park YA, Chaffin CH, Thigpen B, Easly PL, et al. Performance of the Sebia capillary for detection and immunotyping of serum monoclonal paraproteins. Am J Clin Pathol 2007;128:293-9.
RESUMEN
El eczema dishidrótico es una dermatitis crónica, relativamente frecuente que afecta a las manos y a los pies. Se caracteriza por la aparición de vesículas de 1 a 2 mm, recurrentes y crónicas, en palmas, plantas, y caras laterales de los dedos, acompañadas o incluso precedidas de prurito. Su etiología es desconocida, sospechándose que interviene la propia sudoración sobre un fondo atópico. También se la denomina dermatitis eczematosa dishidrótica, eczema paráptico o pómpholix, soliendose reservar el términos pómpholix para el subgrupo de pacientes que presentan erupciones agudas de grandes bullas en manos y pies.
La historia clínica y la exploración física suelen ser suficiente para establecer el diagnostico, caracterizándose por presentar las lesiones descritas y seguir un curso cíclico, alternando recurrencias con remisiones, que a menudo se resuelve sin tratamiento.
Algunos pacientes deberán ser tratados para disminuir la duración de las lesiones y prevenir las recurrenci...
INTRODUCCIÓN
Se entiende por adenopatías, linfadenomegalias o linfadenopatías el aumento de tamaño o la alteración de la consistencia de los ganglios linfáticos. De acuerdo al tamaño se define como adenopatía aquellos ganglios linfáticos mayores de 1 cm. de diámetro, a excepción de los que se presenta a nivel inguinal y epitroclear, donde se consideran patológicos aquellos mayores de 1,5 cm. y 0,5 cm. de diámetro respectivamente, y también a nivel supraclavicular, que se consideran patológicos independientemente del tamaño. En cualquier otra localización corporal se pueden palpar ganglios más pequeños de 0,5 cm sin significado patológico. Sin embargo no solo el tamaño define un ganglio como patológico ya que otras características semiológicas deben ser valoradas, tales como consistencia, adherencia o no a los diferentes planos, sensibilidad.
ETIOLOGÍA
La palpación de ganglios aumentados de tamaño es un hecho frecuente en el ámbito de Atención Primaria, siendo a veces el propio paciente...
INTRODUCCIÓN
La policitemia o poliglobulia se define como un aumento en la masa eritrocitaria. Se caracteriza por un incremento del número de hematíes y/o de la cantidad de hemoglobina por unidad de volumen de sangre. El parámetro hematológico mas apropiado para su valoración es el hematocrito, debiéndose sospechar poliglobulia cuando este se sitúa de forma mantenida dos desviaciones estándar por encima de la media normal: 52% en varones y al 48% en mujeres. En caso de utilizarse la hemoglobina se debe sospechar poliglobulia cuando la hemoglobina es mayor de 18,5 g/dl en varones y de 16,5 g/dl en mujeres.
CLASIFICACIÓN Y ETIOLOGÍA
Es importante diferenciar si la poliglobulia es absoluta, con un aumento real de la masa eritrocitaria, o relativa, en la que hay un incremento de la concentración de hematíes por una pérdida del volumen plasmático, pero la masa eritrocitaria es normal.
Poliglobulia relativa o ficticia
Es la poliglobulia que se produce por disminución del volumen plasmático,...
