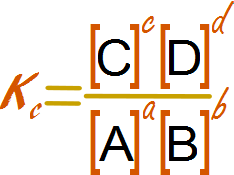
Interpretación cualitativa de la constante de equilibrio
Aritmética de una división y el equilibrio químico Interpretación matemática de la constante de equilibrio 1 Interpretación matemática de la constante de equilibrio 2Interpretación matemática de la constante de equilibrio 3 Interpretación matemática de la constante de equilibrio 2 ¿Qué pasa cuando la constante de equilibrio químico es muy pequeña?
Como ejemplo consideremos la reacción entre el nitrógeno gaseoso molecular y el oxígeno gaseoso molecular para generar monóxido de nitrógeno. Cualitativamente esta reacción bajo las condiciones estándar tiende a generar muy poco monóxido de nitrógeno, lo cual es vital.
La atmósfera del planeta es en su mayoría “más del 70%” está compuesta por nitrógeno molecular gaseoso, mientras que el oxígeno constituye por mucho el 22%”, si esta reacción fuera posible hacia el monóxido de nitrógeno no tendríamos oxígeno para respirar.

La constante de equilibrio en las condiciones estándar para esta reacción es de 4,6X10-31.
El solo observar el valor de la constante de equilibrio nos da una idea de cómo se da la reacción, al ser un valor inferior a 1 y muy cercano a 0 se predice que el equilibrio favorece a la reacción inversa, manteniendo la mezcla de la reacción con una gran cantidad de reactivos y muy poco producto.
Cuantitativamente, si tenemos una concentración de 1 M de nitrógeno molecular y 1M de oxigeno molecular, solo se produce 6,8X10-16.
De hecho, la reacción directa es tan pobre que su producto es prácticamente indetectable, por lo que bien la podemos tratar como una reacción que no ingresa en equilibrio. PRINCIPAL
REGRESAR
