Introducción al
equilibrio químico II
Figura IEQ-01. Esta es literalmente la edad de la petroquímica, los fertilizantes con los cuales hacemos crecer nuestros alimentos son derivados del petróleo, del mismo modo que el material con que se hacen las canastas con las que se transportan, la gasolina que mueve al camión de los transporta, la ropa que visten los operarios que cargan y en muchos casos la maquinaria que se encarga del procesamiento de estos. Los derivados del petroleo son omnipresentes en nuestra sociedad. Figura IEQ-02. Mucho de los vapores producidos por la quema del carbón mineral es dióxido de carbono y agua, sin embargo también existe cierta cantidad de monóxido de carbono, una especie química toxica y con un efecto de invernadero mas potente que el dióxido de carbono. Figura IEQ-03. En la edad de la petroquímica todo depende de la capacidad de una nación para producir y procesar el petróleo y el gas natural, pero los yacimientos de estos materiales no durarán para siempre. Figura IEQ-04. El dióxido de carbono atmosférico no solo incrementa la temperatura del planeta por efecto invernadero, también incrementa la acidez de los océanos, tanto por concentración como por el hecho de que la solubilidad del dióxido de carbono se incrementa con el aumento en la temperatura.
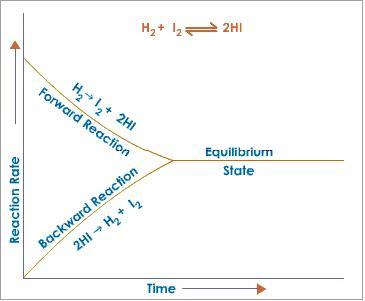
Como
se mencionó anteriormente, la clave para identificar a una reacción reversible
y que por lo tanto ingresa al equilibrio químico es aquella que aparenta
detenerse antes de que todos los reactivos se hubieran consumido (nivel molar o
macroscópico). Mientras que a nivel molecular explicamos que en el equilibrio
los reactivos reaccionan entre sí, para regenerar los reactivos de partida.
Consideremos
por ejemplo la siguiente reacción.

Esta
reacción que requiere un catalizador para poder dares a una velocidad razonable
es denominada metanación catalítica. Esta reacción adicionalmente se la puede
clasificar como una reducción desde el punto de vista del carbono ya que pierde
oxigeno (agente oxidante) y adquiere hidrógenos (agentes reductores) y por lo
tanto requiere de una cantidad importante de energía para poder suceder “no
solo en términos de la energía que logra almacenarse en los enlaces entre
carbono e hidrógeno, sino también en la energía de activación para que la
reacción siquiera empiece a darse”.



Sin
embargo, la metanación catalítica del monóxido de carbono posee un problemita
estequimétrico, es una reacción reversible, esto quiere decir que no todo el
reactivo “que cuesta dinero tanto para conseguir como para preparar de manera
industrial” es consumido por la reacción, más aun, dependiendo de las
condiciones del reactor industrial se puede hasta invertir el sentido de la
reacción, un proceso llamado reformación de vapor

Este
proceso inverso es empleado en algunas industrias que necesitan sintetizar hidrógeno gaseoso.
El
proceso de la metanación catalítica y la reformación de vapor ilustran la
reversibilidad de muchas reacciones químicas. Más aun, el hecho de que solo
alterar las condiciones externas afecte que tipo de reacción se dé, ya nos da
pistas sobre qué es lo que posiblemente se vea afectado en estos procesos, y es
la constante de proporcionalidad de la velocidad de la reacción “la cual como
ya se dijo en el tema anterior es afectada por las condiciones termodinámicas
externas como la presión y la temperatura”.
Por
lo general los equilibrios químicos se describen en términos de disociaciones
en solución acuosa, sin embargo el concepto de equilibrio es mucho más amplio, cubriendo
reacciones que disolución entre especies químicas en fases diferentes.
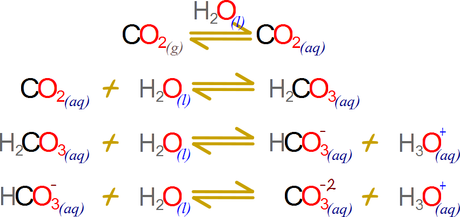
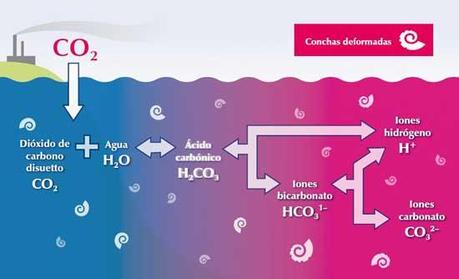
Uno
de los ejemplos más ilustrativos es el del dióxido de carbono que puede iniciar
un equilibrio múltiple. El dióxido de carbono atmosférico ingresa a un
equilibrio con el dióxido de carbono del agua “equilibrio de disolución entre fases”,
pero el dióxido de carbono acuoso a su vez entabla un equilibrio de reacción
con el ácido carbónico “equilibrio de reacción” pero el ácido carbónico entabla
a su vez un primer equilibrio de disociación con el ion bicarbonato “equilibrio
iónico- ácido base” y a su vez en ion bicarbonato puede entrar en equilibrio
con el ion carbonato “equilibrio iónico- ácido base”.
La
biología está llena de reacciones de equilibrio múltiple, donde virtualmente
toda reacción biológica puede y está en algún tipo de equilibrio.
PRINCIPAL
REGRESAR
