En kimireflexiones anteriores hemos hablado sobre el concepto de enlace químico y sobre la regla del octeto, en todo ello se habla del enlace químico de una manera general. Hay tres tipos de enlace químico: iónico, covalente y metálico, cada uno con sus particularidades, pero la explicación a la formación de todos ellos deriva en la regla del octeto.
Antes de continuar leyendo es recomendable escribir la configuración electrónica de todos los gases nobles, ya que será de gran utilidad a la hora de entender esta entrada.
Ahora, vamos a adentrarnos en la explicación del enlace iónico. Para ello tomaremos un elemento del grupo 1 y otro elemento del grupo 17 y escribiremos su configuración electrónica. Por ejemplo el sodio y el cloro, llegándose a:
11Na: 1s22s22p63s1
17Cl: 1s22s22p63s23p5
El gas noble que hay en ese período es el argón y el gas noble que hay en el período anterior es el neón, siendo sus configuraciones electrónicas:
10Ne: 1s22s22p6
18Ar: 1s22s22p63s23p6
¿Qué pasa en la capa de valencia del sodio y del cloro? ¿Se cumple la regla del octeto? No, ya que la configuración electrónica que tienen no es la del gas noble de ese período ni la configuración electrónica del gas noble del período anterior.
¿Qué tiene que pasar para qué se cumpla la regla del octeto? El sodio, para tener una configuración electrónica idéntica a la del helio deberá perder un electrón. Mientras que el cloro para adquirir una configuración electrónica idéntica a la del argón deberá ganar un electrón.
De este razonamiento se concluye que para cumplir la regla del octeto un átomo tiene que ganar electrones y otro átomo tiene que perderlos ¿Cómo pierden y ganan electrones los átomos? Formando iones.
El sodio pierde un electrón, forma un ión positivo (catión) y el cloro como gana un electrón forma un ión negativo (anión). Una vez formados estos iones como un ión tiene carga positiva (el Na+) y el otro ión tiene carga negativa, se atraerán y después se formará el compuesto NaCl, constituyéndose posteriormente la red cristalina.
Esto que acabamos de expresar son una serie de etapas que representaremos a continuación. Empezaremos por escribir nuevamente las configuraciones electrónicas del sodio y del cloro.
11Na: 1s22s22p63s1
17Cl: 1s22s22p63s23p5
La primera etapa es la formación de iones. El sodio al perder un electrón se transforma en Na+, con una configuración electrónica idéntica a la del Ne. Pero ahora esto debemos expresarlo en lenguaje químico, y esto es la siguiente reacción química:
Na ⟶ Na+ + 1e
El electrón se pierde, al perderse se genera, es el producto de una reacción química y por eso se escribe a la derecha. Esto se puede interpretar de otra manera que es que como el Na pierde el electrón este se resta, es decir:
Na – 1e ⟶Na+
Pero las reacciones químicas se expresan como sumas y no como restas. Una reacción química es como una ecuación matemática, en la que en vez de haber un igual hay una flecha, lo que está a la izquierda de la flecha restando pasa al otro miembro sumando, resultando así:
Na ⟶ Na+ + 1e
Una vez formado el sodio, estudiaremos como se forma el cloro. El cloro al ganar un electrón se transforma en Cl-, adquiriendo la configuración electrónica del Ar. Nuevamente expresamos esto con reacciones químicas, es decir:
Cl + 1e ⟶ Cl-
Ahora el electrón se gana, por eso se coloca a la izquierda de la flecha de la reacción química.
Una vez formados los iones, comienza la segunda etapa, denominada atracción electrostática. En la anterior etapa el Cl le cedió 1e al Na y se formarón dos iones, un ión cargado positivamente y un ión cargado negativamente, que se atraen formando la red cristalina. Y esto se representa de la siguiente manera:
[Na+, Cl-]
La tercera y última etapa, se denomina formación del cristal iónico para algunos autores formación del compuesto. Los iones Na+ y Cl-formados se aproximan creando una estructura de muchos iones Na+ y Cl- alternados.
Na+ + Cl- ⟶ NaCl
Se formaría una estructura como la que se muestra a continuación. Dónde las bolas pequeñas son átomos de sodio ionizados y las bolas grandes son átomos de cloro ionizados.
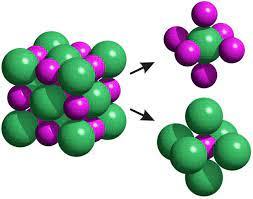
Figura 1 – Estructura NaCl. Índice de coordinación
Podemos preguntarnos, si el radio atómico aumenta de derecha a izquierda en la tabla periódica ¿No sería la bola grande el sodio y la bola pequeña el cloro? Esto es cierto, pero aquí estamos hablando de iones. El tamaño de los iones varía de una manera distinta a como varía en los átomos, pero esta es una cuestión que no procede debatir aquí.
Aprovechando esta imagen, introduciremos un concepto, el índice de coordinación (IC). Que es el número de iones de signo opuesto que rodean a un ión determinado en la red cristalina.
Para entender esto no reemitiremos a la izquierda de la figura 1, si extraemos un ión de cloro y vemos cuantos iones de sodio tiene a su alrededor (parte superior derecha de la imagen), vemos que tiene seis iones de sodio a su alrededor por lo tanto el índice de coordinación es 6. Este razonamiento sería similar para el sodio llegándose al mismo valor del índice de coordinación.
19 de Marzo de 2021
Descubrir La Química. Graduada en Química por la Universidad de Santiago de Compostela. Estudiante del Máster en Formación del Profesorado.