La Autoionización del agua
¿Qué es el agua?En las soluciones acuosas dos iones poseen funciones preponderantes, estos son el ion hidronio (H3O+) el cual por comodidad es generalmente reducido a protones (H+) el ion hidróxido.
¿Cómo existe el agua?, a cualquier persona a la que se le pregunta generalmente responde que el agua es H2O, pero más allá de eso, seguir inquiriendo en esa pregunta parece estúpido, ¿cierto? La respuesta es que lo realmente tonto es quedarse en esta respuesta.
Por un lado asume que el agua puede reducirse a una molécula desnuda. Del mismo modo en que una molécula de un fosfolípido no puede ser llamada una membrana biológica, una base nitrogenada no se llama ADN, o un aminoácido no se llama proteína, una sola molécula de H2O no debe ser llamada agua.
El agua es un material macroscópico que surge de la organización de las moléculas de H2O. Pero, ¿Cuál es la diferencia?, el problema aquí es que cuando se estudia al agua desde su organización multi-molecular se tienen en cuenta una serie pde propiedades que una molécula de agua desnuda jamás presentaría.
Por ejemplo, si asumiéramos que el agua líquida es igual a su representación molecular, es decir una sustancia eléctricamente neutra, se esperaría que el agua pura y ultrapura no presentaran el fenómeno de condición eléctrica que presentan las soluciones que poseen iones o radicales con cargas no equilibradas.
Sin embargo, cuando se realizan las mediciones del caso ocurre un fenómeno muy peculiar, aunque débil, el fenómeno de conductividad eléctrica se presenta. Uno diría que es porque la solución es impura, sin embargo, con el mejoramiento de los métodos de purificación esta propiedad del agua no ha hecho más que ser medida con más precisión.
Por lo anterior tenemos que si (1) las soluciones que condicen la electricidad contienen iones, (2) aunque débil el agua conduce electricidad aun cuando se purifica al máximo posible en la práctica, (3) el agua debe producir iones en cantidades irrisoriamente pequeñas en comparación con el resto de moléculas que la forman.
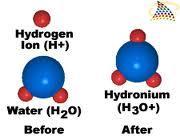
El modelo molecular que da cuenta de este fenómeno de conductividad débil del agua se denomina Autoionización, y es la propiedad que tiene el agua de reaccionar consigo misma produciendo leves cantidades de dos iones, el ion hidronio y el ion hidroxilo.

El agua líquida por lo tanto existe no como una especie química única (H2O), sino como el flujo dinámico de tres especies mediante una reacción reversible.
Un detalle más que se puede concluir cualitativamente de los experimentos de conductividad es que la cantidad de los iones generados debe ser baja en comparación con la cantidad de agua mmolecularque existe en la solución, de lo contrario la solución de agua ultrapura sería más conductiva.
Para determinar los valores de los iones en comparación al agua molecular deberemos emplear en concepto de la constante de disociación tal como la empleamos en el tema de equilibrio químico. PRINCIPAL REGRESAR
