
La energía libre de Gibbs La energía libre y la segunda ley de la termodinámica Interpretación de la energía libre de Gibbs Energía libre estándar y sus cambios Aplicación de las variables termoquímicas ΔH, ΔS y ΔG La energía libre y la segunda ley de la termodinámica
La definición de la entropía del sistema químico y la entropía de los alrededores del sistema químico podemos describir a la segunda ley de la termodinámica solo en términos del sistema químico (reacción) ignorado a los alrededores.
Ahora, debemos enunciar una nueva variable que nos ayuda a determinar la espontaneidad de un proceso, primero despejaremos las variables el sistema lo mas posible.
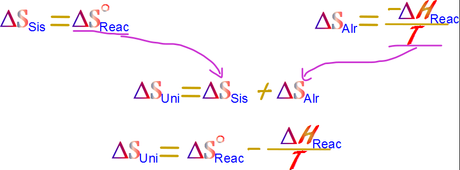
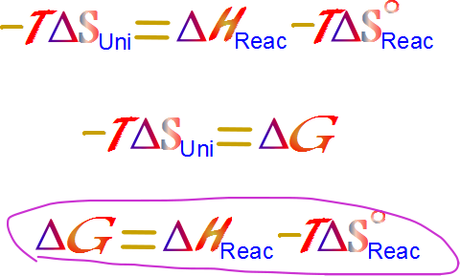
El lado izquierdo de la reacción sigue teniendo el mismo significado en los signos, los procesos espontáneos son positivos, y los imposibles son negativos. Este lado izquierdo de la reacción es casi nuestra nueva variable, solo falta un cambio y es la inversión de los signos, pues es de este modo en que podremos conceptualizar fácilmente el significado de la variable.

La nueva variable se denomina energía libre de Gibbs, y valor obtenido aquí es el cambio en la energía libre de Gibbs.
 PRINCIPAL
REGRESAR
PRINCIPAL
REGRESAR
