A lo largo de la historia, la humanidad ha afrontado epidemias de diversas magnitudes, algunas devastadoras, como la llamada plaga de Atenas, en el año 430 a.C., en plena Segunda Guerra del Peloponeso. No se conoce la naturaleza de la plaga, pero según el historiador Tucídides, que la contrajo y sobrevivió, la ciudad de Pericles tardó 50 años en recuperarse y, durante esa época, la desesperanza fue tal que sus habitantes perdieron la fe en los dioses y en las leyes ante una inminente muerte. Según Tucídides, la plaga vino de Etiopía y pasó luego a Egipto, Libia y Grecia. Incluso los espartanos que asediaban Atenas se retiraron por el temor a la epidemia.

La peste negra asoló Europa y Asia en el siglo XIV, siendo probablemente la pandemia más terrible que ha sufrido la humanidad; su pico se produjo entre los años 1347 y 1353, y sólo en Europa se registraron 25 millones de víctimas, ¡la tercera parte de su población!, y entre 40 y 60 millones en África y Asia. Se cree que su origen fue de nuevo África y los cálculos indican que se extendió ferozmente por Asia y Europa. Las consecuencias sociales fueron enormes y, posiblemente, fue una de las principales causas del fin de la Edad Media.
Otro episodio terrible está asociado a la mal llamada gripe española de 1918, que acabó con 25 millones de vidas en todo el mundo en sus primeros seis meses (aunque algunas fuentes llegan hasta los 100 millones en total). Comenzó en Estados Unidos, en los campamentos militares donde los soldados eran preparados antes de ser enviados a Europa durante la Primera Guerra Mundial. La gripe se extendió pronto a Francia, Italia y Alemania, y después a España, país neutral que informó a través de sus periódicos del tema sin censuras, al contrario de los países en guerra. Estudios recientes han identificado el virus causante como un virus aviar.
En tiempos recientes hemos asistido a la emergencia del sida, de la gripe aviar de 2009 o del ébola, mientras que regiones enteras del planeta sufren de manera habitual desde hace décadas, incluso siglos, enfermedades como la malaria, el dengue o, más recientemente, el zika. Hemos temblado con las noticias de pandemias causadas por virus de animales, como el SARS (murciélagos en China) y el MERS (murciélagos en Arabia Saudí). Estos dos últimos casos son producidos por coronavirus; es decir, virus que padecen algunos animales y que, en algún momento, sufren una mutación que les permite atacar también a los humanos (a veces por una especie intermedia).
En nuestros días, conocemos al enemigo bastante mejor que los atenienses o los europeos de la Edad Media gracias, en particular, a tres grandes contribuciones de la segunda mitad del siglo XIX y principios del XX: la teoría germinal de las enfermedades del francés Louis Pasteur; la identificación del virus del tabaco del ruso Dimitry Ivanovski, usando el filtro Chamberland-Pasteur; y la invención del microscopio electrónico, que desde 1931 permite fotografiar al enemigo.
Aunque el SARS-nCoV-2 (inicial y comúnmente conocido como Covid-19) es un nuevo virus y nos pone ante un nuevo desafío, no resulta totalmente desconocido por pertenecer a la familia de los coronavirus (Figura 1). No obstante, la pandemia que ha generado no sólo tiene que ver con los aspectos biológicos del virus sino, quizá con mayor importancia, con aspectos sociales y demográficos.
Figura 1: Coronavirus y sus características espínulas en forma de corona.
Es verdad que las matemáticas no curan enfermedades directamente, pero sí ayudan a explicar cómo se extiende un cáncer o propaga una epidemia, o a medir la efectividad de una vacuna o testar la de un medicamento. En ocasiones, las matemáticas ayudan modestamente a comunicar mejor o incluso a simular escenarios que ayuden a la toma de decisiones. Las herramientas que están más cercanas a estos problemas son las ecuaciones diferenciales y los modelos estocásticos, pero también la teoría de juegos, big data, machine learning y, en general, el análisis de datos juegan ya un papel relevante, especialmente cuando queremos incluir los aspectos de las conductas sociales.
SARS-CoV-2 y las matemáticasEn estos momentos de angustia en torno al infame coronavirus, llegan voces desde distintos campos de la ciencia tratando de echar una mano para entender o mitigar la pandemia. En un mundo de biotecnología parece extraño acudir a las matemáticas para resolver los enigmas que el SARS-CoV-2 nos plantea. Esto se debe a que, normalmente, no se concibe la conexión entre las matemáticas y la realidad más allá de "contar con los dedos" como aprendimos a hacer de niños.
Para probar al lector que esto no es así, seamos osados y ¡contemos con los dedos! Imaginemos que cuando acabe todo fuésemos capaces de determinar quién contagió a quién. El lector podría ser el primer portador del virus y haber estrechado la mano o tosido delante de otras 3 personas que se contagiaron a su vez. Luego, cada una de estas tres personas habrían contagiado a otras 3 (y ya van 1+3+9) que, por avatares de la vida, habrían propagado la infección a otras 3 (es fácil contar: 1+3+9+27). Matemáticamente, esto se conoce como progresión geométrica o, como se repite en los medios estos días, crecimiento exponencial. En epidemiología, ese número 3 se conoce como ritmo (o factor) reproductivo básico,, y representa el número medio de contagios propagados por cada persona contagiada. Este número tiene que ser mayor que 1 para que haya epidemia y, como parece natural, cuanto mayor es, más explosiva será la epidemia. Por poner unos ejemplos, el sarampión tiene un valor entre 12 y 18, y el ébola y la gripe común entre 2 y 3. Con no somos capaces de medir cómo de letal es un virus, sólo cómo de infeccioso ha sido en una cierta población. A partir de los datos de China, se observa que SARS-CoV-2 tiene un factorestimado en 2,68 (aunque sospechamos que, en el caso de Italia o España, podría ser mayor).
Las medidas de higiene y distanciamiento social que sufrimos en estos días permiten hacer decrecer y, por tanto, mitigan el impacto de la propagación de SARS-CoV-2. Para cuantificar este impacto, proponemos utilizar un modelo matemático (y sus variantes) ya existente propuesto por el escocés Anderson Gray McKendrick en el año 1926, conocido como modelo SIR de epidemias. Con los términos SIR se hace énfasis sobre los tres estados de un individuo ante la enfermedad - susceptible (sano), infectado (infeccioso con capacidad para contagiar a otros) y removido (recuperado e inmune a nuevas infecciones, o fallecido) -, así como su evolución S -> I -> R en el tiempo. Los estados dan lugar a tres compartimentos - o subpoblaciones de individuos susceptibles, infectados y removidos - que permiten clasificar a los individuos de la población en cada instante de tiempo.
En términos del modelo SIR, la propagación de SARS-CoV-2 está vinculada al sistema de ecuaciones diferenciales para las proporciones s(t) de susceptibles, i(t) de infectados y r(t) de removidos respecto al tamaño N de la población (que se asume constante) dado por
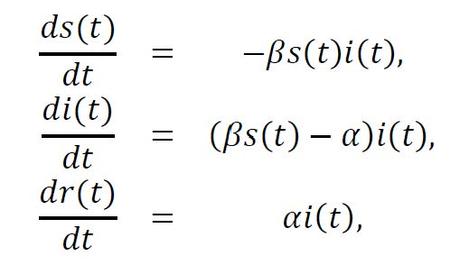
donde β es la tasa de infección y αes la tasa de recuperación, en el supuesto de las proporciones iniciales, y r(0)=0. En lenguaje cotidiano, la primera ecuación nos dice que la velocidad con la que decrece el número de susceptibles es proporcional al producto s(t) i(t), donde este producto se puede interpretar como la probabilidad de que una persona susceptible se encuentre con una infectada y el parámetro β mide la probabilidad de que el contagio sea exitoso. Es interesante entender que β tiene tanto que ver con el número promedio de "encuentros" entre personas susceptibles e infectadas, como con el resultado de esa infección. Como discutiremos más adelante, esto tiene implicaciones en las políticas de aislamiento y de higiene.
Una sencilla interpretación de los signos de las derivadas de s(t), i(t) y r(t), garantiza que la proporción de individuos susceptibles disminuirá hacia su valor final s y la proporción de removidos se incrementará hacia un valor final r mientras que, en ambos casos, existan individuos infectados. Por el contrario, la proporción de infectados aumentará si βs(t)>α y disminuirá si βs(t)<α.
La principal propiedad del modelo SIR, aplicado a SARS-CoV-2 o a cualquier otro patógeno, es que la propagación de la enfermedad termina con el paso del tiempo (es decir, la enfermedad es no endémica) ya que
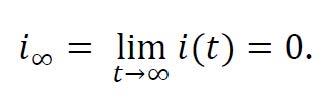
Sin embargo, hay que distinguir dos posibles comportamientos hasta que se produzca la extinción de la enfermedad dependiendo del factor reproductivo básico, que en el modelo SIR se expresa como β⁄α:
- Cuando < 1 (en promedio, un individuo infectado se recupera antes de transmitir la enfermedad), la relación garantiza que la proporción de infectados disminuye desde el primer momento y la enfermedad desaparece con rapidez. En tal caso, la máxima proporción de infectados durante un episodio de la enfermedad se observa en el instante inicial,.
- Cuando > 1 (en promedio, un individuo infectado transmite la enfermedad antes de recuperarse), la proporción de infectados podría decrecer desde el primer momento si , mientras que podría aumentar inicialmente hasta la máxima proporción
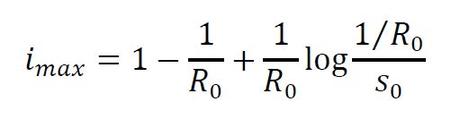
y luego decrecer hasta la extinción cuando . En este segundo caso, tiene sentido hablar de epidemia y el pico de la infección se alcanza cuando la proporción de susceptibles coincide con el umbral crítico α/β, es decir, en el instante de tiempo > 0 que verifica = 1/. Como mencionamos con anterioridad, el coronavirus SARS-CoV-2 tiene un valor de próximo a 2,68, por lo que si toda la población fuese susceptible al virus (ésto no sabemos si es así a día de hoy), el virus podría infectar simultáneamente a casi un cuarto de la población si no aplicamos ninguna medida de precaución o control.
La magnitud de - pequeña o grande - es fundamental para determinar si los recursos sanitarios son suficientes o no ante la propagación de SARS-CoV-2. Para ello, basta traducir la capacidad del sistema sanitario en términos de un número i* que refleje sus limitaciones (por ejemplo, en términos de la proporción de camas hospitalarias en UCI disponibles para atender a una población de individuos), y concluir que los recursos son suficientes si se tiene o, por el contrario, son insuficientes cuando.
¿Qué hacer si se prevé que los recursos sanitarios no serán suficientes?Para entender cómo podemos revertir una situación de alarma, , en otra aceptable, , es importante hablar de dos conceptos y la relación entre ellos:
- La velocidad exponencial de crecimiento
- Las medidas de contingencia
Para complementar nuestros comentarios sobre y la noción de velocidad exponencial de crecimiento de una epidemia, nos fijamos en la proporción j(t) = i(t) + r(t) de individuos afectados por la enfermedad hasta el instante t (si se estuviesen realizando tests masivamente en la población, esta proporción debería coincidir con los datos que aparecen en los medios asociada a los "casos confirmados"); a partir de esta proporción, podemos estimar el número acumulado de fallecidos, dado por ρNj(t), donde ρ es el índice de letalidad de la enfermedad. En concreto, el valor ρ=0,023 estimado en China refleja que el porcentaje de fallecidos entre los afectados por SARS-CoV-2 es el 2,3%. Matemáticamente, se puede encontrar una expresión explícita para la fracción de afectados:
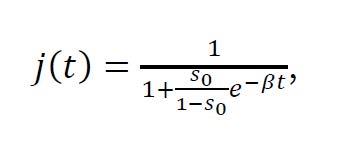
que muestra que la proporción j(t) es inversamente proporcional a, de manera que el número acumulado de afectados Nj(t) se incrementará a la misma velocidad que el valor de decrezca cuando el tiempo t se incremente.
Como j(t) es una función creciente del tiempo y sus valores mínimo y máximo son(en el instante de aparición del patógeno) y 1-s (en el instante de extinción), con , su crecimiento no es siempre del mismo tipo. En concreto, existirá un intervalo de tiempo donde la velocidad del crecimiento de j(t) aumenta hasta alcanzar su valor máximo. Para determinar ese intervalo, traducimos la velocidad de crecimiento de j(t) en términos de su derivada
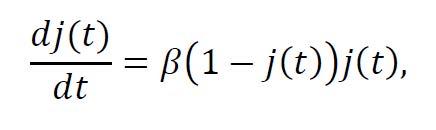
y determinamos su valor máximo como función de j(t), dentro del rango ≤ 1 . Desde la Figura 2 es sencillo llegar a la conclusión de que la máxima velocidad de crecimiento se alcanzará cuando j(t) = 1/2 y lo habrá hecho en un instante de tiempo antes del cual la velocidad de crecimiento crece hasta su valor máximo β/4 y, después del cual, la velocidad comienza a decrecer progresivamente.
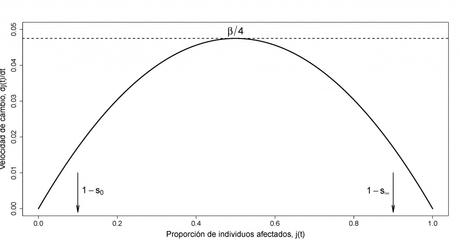
Figura 2: La velocidad de crecimiento de (es decir, dj(t)/ dt) como función de j(t).
Desde lo anterior, es claro que la curva del número acumulado de afectados por SARS-CoV-2 no se suavizará hasta que el 50% de la población no se haya visto afectada por la epidemia, siempre que la epidemia no se haya extinguido antes.
En el supuesto de que SARS-CoV-2 siga propagándose, ¿cómo podemos suavizar la curva del número acumulado de afectados? La respuesta se encuentra entre nuestras observaciones anteriores:
Minimizando el valor máximo β/4 de la velocidad de crecimiento.
Eso significa "disminuir la tasa de contacto entre individuos" para hacer posible disminuir la tasa de transmisión β, en el mismo sentido que el factor reproductivo básico. En este punto, toman sentido las medidas de distanciamiento social, así como medidas profilácticas (uso de guantes, mascarillas, lavado de manos) dictadas por los Gobiernos de los países afectados por SARS-CoV-2.
Pongamos un ejemplo para poner de manifiesto las repercusiones de una medida de contingencia, como el distanciamiento forzoso de los ciudadanos, ante la enfermedad Covid-19 asumiendo que el valor = 2,68 del factor reproductivo - publicado en la revista científica Lancet- es correcto; en ese caso, la tasa de contagio estimada es β y el tiempo medio de transmisión es, aproximadamente, 1/β= 5,26 días. Tomemos cuatro escenarios:
l Escenario 1: Sin medidas de contingencia. Representa la propagación de SARS-CoV-2 sin medidas de control, es decir, β y = 2,68.
l Escenario 2: Medidas de contingencia leves. Se ponen en práctica medidas de control de baja intensidad () que conducen a = 2,39.
l Escenario 3: Medidas de contingencia moderadas. Se ponen en práctica medidas de control de intensidad media () que conducen a = 2,13.
l Escenario 4: Medidas de contingencia severas. Se ponen en práctica medidas de control de alta intensidad ()) que conducen a = 1,33.
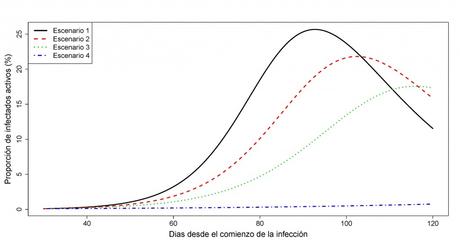
Figura 3: Variación de la proporción de infectados i(t) en función de la intensidad de las medidas de contingencia.
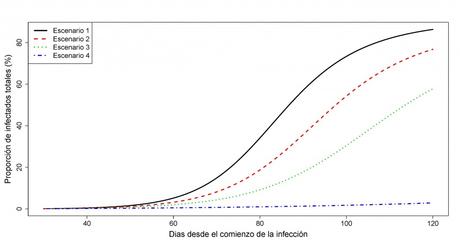
Figura 4: Variación de la proporción de individuos afectados j(t) en función de la intensidad de las medidas de contingencia.
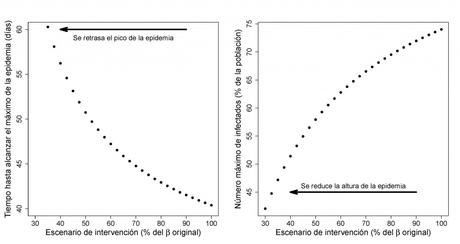
Figura 5: Tiempo transcurrido hasta alcanzar el pico de infección y proporción máxima de individuos simultáneamente infectados en función de la intensidad de las medidas de contingencia.
Observando detenidamente las Figuras 3 y 5, es claro que el pico de infección, en términos de la máxima proporción de infectados, disminuye a la vez que el instante de ocurrencia del pico de infección se incrementa cuando se ejecutan medidas de control más severas; en tal caso, una adecuada especificación del umbral i* de capacidad límite de los recursos sanitarios permitirá definir medidas de contingencia concretas, sin que resulten ser excesivas para los ciudadanos. El incremento del número de días desde el inicio de los contagios hasta alcanzar el pico de infección también permite dar cabida al desarrollo de tratamientos paliativos (antivirales) y acercarnos a la fecha en la que una vacuna pueda estar disponible y ayude a poner fin definitivamente a la epidemia.
Además, la imposición de medidas de contingencia más restrictivas hace que la franja de variación de la proporción de individuos afectados j(t) en la Figura 4 se contraiga, al decrecer su valor límite , lo cual permitirá disminuir el impacto de la enfermedad, medido en términos del número de individuos que se verán afectados.
Es importante observar que la tasa de recuperación α se ha mantenido constante en el ejemplo, reflejando que no existe tratamiento específico o vacuna que permite mejorar el tiempo medio de recuperación. Por ello, todos los esfuerzos de lucha frente a SARS-CoV-2 están orientados hacia la disminución de la tasa de contagio β.
El modelo y sus limitacionesNo queremos engañar al lector: el modelo SIR es un modelo inicial - la comunidad científica anglosajona usa el término toy model para referirse a un modelo de partida que progresivamente es mejorado - y nuestro anterior ejemplo es ideal. Con seguridad, ambos estarán muy alejados de una realidad que, por ahora y hasta que la pandemia de SARS-CoV-2 se estabilice, no conoceremos con detalle. En ese momento, las estimaciones de las tasas de contagio y de recuperación serán más precisas y el modelo se verá seriamente modificado por la necesidad o no de distinguir entre susceptibles, infectados-asintomáticos, infectados-sintomáticos, recuperados-infecciosos y recuperados (incluyendo a los fallecidos) si se confirman los diferentes indicios epidemiológicos en ese sentido. Incluso el modelo podría ser estructurado por edades y patologías previas para reflejar diferentes niveles de letalidad de la enfermedad, e incluso modificado cuando una vacuna efectiva sea conocida. Otros caminos no tan evidentes y que merecen ser explorados consistirían en asumir que los parámetros del modelo son cambiantes (debido a medidas políticas, al temor de los ciudadanos frente a las noticias, ...). O, por poner otro ejemplo, la suposición de que el contagio es proporcional a s(t) i(t) debería modificarse para reflejar la compleja red social de contactos; en particular, se sabe que la mayoría de los ciudadanos se mueven en círculos de contactos pequeños, pero algunos individuos, llamados superpropagadores, son capaces de llevar la enfermedad de una ciudad a otra o, como en el caso de SARS-CoV-2, de un continente a otro.
No nos cabe ninguna duda de que, para conseguir un modelo predictivo suficientemente preciso para el estudio de SARS-CoV-2, será necesario realizar un esfuerzo multidisplicinar entre epidemiólogos, inmunólogos, neumólogos, bioestadísticos y matemáticos, entre otros. Desde el lado de las matemáticas y, en general, de todas las ramas de la ciencia, ya existen algunas iniciativas para desarrollar modelos más precisos que permitan evaluar cuantitativamente el impacto de estas medidas.
Hasta ese momento, los autores esperan haber convencido al lector - inclinado o no hacia las matemáticas- de la importancia de esforzarnos en hacer disminuir la tasa de contagio β, es decir, de respetar el consejo
¡Quédate en casa! -Mario Castro Ponce (Universidad Pontificia Comillas), Manuel de León (Instituto de Ciencias Matemáticas CSIC, Real Academia e Ciencias) y Antonio Gómez Corral (Universidad Complutense de Madrid)
Si te gustó esta entrada anímate a escribir un comentario o suscribirte al feed y obtener los artículos futuros en tu lector de feeds.