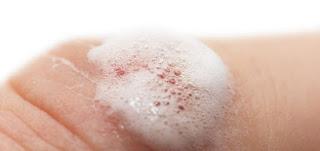
Cuando nos hacemos una herida y sangra, muchas veces lo que hacemos después de lavarla bien, es echarle agua oxigenada “para que deje de sangrar” ¿Por qué al echarle agua oxigenada a una herida, esta deja de sangrar?
Antes de ver esto, debemos repasar los conceptos de catalizador y de enzima. Un catalizador es una sustancia que se introduce en la reacción con el fin de acelerarla, pero que no altera los productos que se obtendrían. Un enzima es un catalizador de origen biológico, suelen ser proteínas, es decir macromoléculas.
Es decir, una reacción química A+B èC+D, si mezclamos A con B la reacción podría ocurrir pero esta es muy lenta. No nos interesa que esta reacción sea tan lenta, por lo que necesitamos echarle algo para que vaya más rápido, pero tampoco queremos que la reacción se altere. Hay unas sustancias específicas para cada reacción, que se llaman catalizadores que lo que hacen es acelerar este proceso pero sin modificar los productos obtenidos.
Entonces, una vez introducidos estos conceptos, ahora vamos a la temática de la entrada ¿Por qué el agua oxigenada hace que nuestras heridas dejen de sangrar? La explicación es simple, en nuestro cuerpo ocurren reacciones químicas, y cuando adicionamos agua oxigenada ocurre una reacción química.
El peróxido de hidrógeno se descompone en agua y oxígeno. Esa espumita que vemos en las heridas al adicionarle agua oxigenada es oxígeno. Lo que ocurre es que el oxígeno es un gas y hace presión sobre la herida y así esta deja de sangrar.
Esta reacción, es una reacción que ocurre, pero es lenta. En nuestra sangre contamos con un catalizador de origen biológico (es decir un enzima) llamado catalasa que lo que hace es acelerar la reacción de descomposición.
Esto explicado con reacciones químicas sería:
2H2O2(aq) →2H2O (l) + O2(g)
Esta reacción, es de descomposición y a su vez REDOX.
Reducción: 2H+ (aq) + H2O2 (aq) + 2e →2H2O (l) Eº = 1,77 VOxidación: H2O2(aq) →O2(g) + 2H+ (aq) +2e Eº = -0,695 V
Reacción Global: 2H2O2 → 2H2O (l) + O2 (g) Eº = 1,075 V
La energía libre de Gibbs es negativa, esto significa que la reacción es espontánea desde el punto de vista de la termodinámica. Pero desde el punto de vista de la cinética, la reacción es lenta, por tanto es necesario que algo la acelere (como cuando pisamos el acelerador del coche porque vamos demasiado despacio) y esto es la catalasa.
20/04/2018
Esta entrada participa en la LXVII edición del Carnaval de Química. Holmio. Alojada en el blog descubrirlaquimica2, @descubrequimica:


