Los reactores y el principio de Le-Chatelier
Aquí es donde la situación física donde ocurre la reacción cobra importancia. Generalmente estamos acostumbrados a un reactor fijo, donde ponemos unos reactivos y después de activar las condiciones de reacción y esperar algún tiempo, esperamos obtener un máximo de producto.
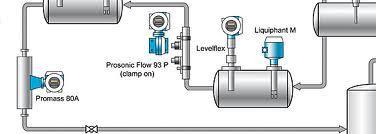
Figura LEL-01. Un proceso industrial por lo general consta de varios reactores unidos de manera continua, cada reactor ejecuta un paso del proceso en presencia de un catalizador y unas condiciones específicas.
Sin embargo como hemos visto hasta el momento las reacciones que entablan equilibrios químicos no son tan fáciles de manipular, y aquí es donde ingresa el tipo de reactor. En los todos artículos anteriores vimos que adicionar reactivos y eliminar productos de la mezcla de reacción mantiene a la reacción sucediendo fuertemente hacia el lado de los productos, haciendo que se consuman de manera eficiente los reactivos.Esta idea teórica ha sido llevada a la practica con el así llamado reactor continuo o de flujo.
Los reactores de flujo son continuamente alimentados y también tienen un punto de salida continuo de productos. Los reactores continuos son empleados especialmente por las industrias bioquímicas y farmacéuticas debido a que las reacciones químicas de índole biológico entablan casi universalmente relaciones de equilibrio químico PRINCIPAL
REGRESAR
