Cabo Udra
Dicen que hay personas en la vida que nos marcan, que nos hacen madurar, dar lo mejor de nosotros y darnos cuenta de lo que podemos ser capaces de hacer. Pueden ser amigos, profesores, familiares, compañeros ... Esta entrada se la dedico a tres personas: - A una amiga, que me ha hecho ver que la vida en muy poco tiempo puede cambiarte y hay que disfrutar día a día de la vida. El hecho de que te cambie la vida no significa que debamos deprimirnos, sino que hay que buscar la manera de tirar para adelante, aunque a veces tenemos pérdidas muy grandes. Hay que ganar batalla tras batalla, pero también hay que saber asumir las derrotas y aprender de ellas para no volver a cometer los mismos errores. - A dos profesoras de inorgánica que tuve este año. Son personas de las que puedes aprender mucho tanto como personas como profesoras. Aunque una me dio más tiempo clase que la otra puedo considerar que las dos han tenido una gran influencia en mí. Una de ellas me daba una asignatura que era el primer año que la daba y no era fácil de explicar, ella misma reconocía que cuando era estudiante los contenidos de esa asignatura eran su cruz, pero con esfuerzo y dedicación consiguió preparar esa asignatura para poder explicarla y que le entendiesen los alumnos; nos animaba a esforzarnos diciendo que si trabajábamos íbamos a aprobar. La otra profesora, que espero que la temática de este artículo le resulte familiar ya que está relacionada con uno de los caballos de batalla de su asignatura, fue una persona que me recordó que no puedes pretender que las cosas te salgan a la primera, que si no te salen hay que tener paciencia y no desistir; ella misma, cuando no entendías algo a la primera te lo volvía a explicar con mucha paciencia, no lo había conseguido a la primera; pero no perdía la calma y conseguía que lo entendieses.
Adriana estaba desayunando y repasando mentalmente que Elena y ella estuviesen cumpliendo objetivos. Bien era cierto que tenía todo el verano por delante para preparar una asignatura, dos meses daban para mucho, pero era verano Elena evidentemente quería salir y disfrutar. Era cierto que Santiago de Compostela durante el verano perdía mucha vida ya que los estudiantes universitarios se marchaban a su casa, pero Elena tenía su pandilla de amigos y quería quedar con ellos. Por las tardes subían hasta las piscinas del Sar en autobús si hacía calor y si estaba nublado o llovía o bien daban un paseo por la Alameda o bien iban hasta el centro comercial as Cancelas al cine o a los recreativos. Eso era lo que habían pactado ella y Elena. Elena podría salir con sus amigos por las tardes si por las mañanas estudiaba y asimilaba correctamente los conceptos de física y química que le explicaba su tía y por la noche antes de irse a dormir repasaba y hacia los problemas que le ponía su tía. Iban bien de tiempo, hoy les tocaba repasar como se sacaban las configuraciones electrónicas especialmente las del bloque d que a Elena le costaba mucho ya que tenía que saberse de memoria la primera serie de transición y le costaba mucho … También tenían que repasar como hacer estructuras de Lewis y deducir la geometría de una molécula a partir de ella. Hibridación no se la pedían en este curso y menos mal … A ver que podían hacer. Ahora estaba bastante centrada cuando hacía los ejercicios, ya no estaba con el móvil cazando pokemons, los pokemons los cazaba por la tarde con sus amigos.-Buenos días – dijo Elena que acababa de entrar en la cocina-Buenos días Elena – dijo su tía – ¿Vienes a desayunar no? ¿O ya desayunaste?-Sí vengo a desayunar – contestó Elena -Muy bien, tienes ahí el pan y el tostador. La mermelada y la mantequilla están en la nevera.- ¿Mamá ya se marchó a trabajar? – preguntó Elena- Si, hoy se marchó antes … tenía una reunión -Ah vale es que normalmente se marcha cuando me levanto, pero hoy no.-Ya es que le mandaron un WhatsApp ayer a la noche – le explicó su tía – ya estabas dormida.- Ah vale – dijo Elena - ¿Qué nos toca mirar hoy? -Pues hoy vamos a repasar configuraciones electrónicas y estructuras de Lewis que aún estás un poco verde en ese tema. Sobre todo, sacar la configuración d de la primera serie de transición, aún sigues fallando en que se arrancan primero los electrones de la capa s y luego los electrones de la capa d. Por no decir que no te sabes la primera serie de transición, pero ahí poco puedo hacer, a ver si a base de hacer ejercicios te la aprendes. -Podía darnos tabla periódica completa la profesora, pero no, nos la da a trozos … - se quejó Elena-Bueno no te quejes, que realmente lo que te tienes que aprender no es tanto … los halógenos, la primera serie de transición y la segunda fila del bloque p, el resto de la tabla periódica te la da … a mí me exigían mucho más; me tenía que saber todo el bloque s, todo el bloque p, casi todo el bloque d … algún elemento de la segunda y la tercera serie de transición nos lo perdonaban y los gases nobles. Resumiendo, menos los lantánidos y actínidos teníamos que sabernos la mayor parte de la tabla periódica. De hecho, en el examen hasta nos la mandaban dibujar … - ¿Y no hacíais chuletas? – preguntó Elena – Yo me moriría si tuviera que aprenderme toda la tabla periódica.- Elena, yo en mi vida hice una chuleta – respondió su tía – y en mi época no copiaba la gente tanto como ahora que copiáis con el móvil … - Eh ¡Que yo no copio! – exclamó Elena – sólo quiero decir que si tuviera que aprenderme todo eso seguramente me plantearía el hacer una chuleta.-Bueno tu por lo menos te pasarías el trabajo de hacer la chuleta y algo aprenderías, pero hay gente que coge los apuntes, les hace fotos con el móvil y luego en el examen copia y así se saca la carrera … algunos ni se molestan en hacer fotos, en el examen se ponen a buscar con el móvil en internet – relató su tía – Respondiendo a tu pregunta, existían tablas periódicas de bolsillo para aquellos que tuviesen memoria fotográfica, eran bárbaras. La mirabas en el autobús, en la cola del supermercado … luego te podías hacer un póster para la habitación y se te quedaba.
Tabla periódica de bolsillo
-Que yo no lo miraría – dijo Elena -En fin … y luego estaban las reglas nemotécnicas, que cada uno se inventaba las suyas … discurríamos, mar en calma no hizo marinero experto.
-Eso me gusta más, reglas nemotécnicas … -Sí, pero tienes que acordarte luego de la regla sino no vale – su tía hizo una pausa – por cierto, si haces chuletas a mi déjame al margen yo no quiero saber nada ¿Vale?-Tía, que no voy a hacer chuletas, que para copiar hay que saber y yo fijo que me pongo nerviosa y me pillan … pero lo de las reglas nemotécnicas está bien … veamos – cogió su móvil y buscó una tabla periódica – bueno creo que me la voy a descargar, esta parece que está bien y además se ve bien, me la voy a poner de fondo de pantalla a ver si así me la aprendo. Porque si me la descargo como una imagen luego fijo que no la miro.-Bueno, me gusta que uses internet para esas cosas, además de para chatear y para cazar pokemons internet tiene muchos usos, por cierto, si le pusieses unas fotos de pokemons a la tabla periódica fijo que la mirabas más. -No se … sigue siendo la tabla periódica … sigue siendo aburrido …-Fijo que en internet hay juegos para aprenderse la tabla periódica – dijo su tía y se puso a buscar con su Smartphone – mira este tiene buena pinta … se llama QuiMitris, es como el tetris pero con la tabla periódica, mira con las líneas seleccionas la región donde quieres que caiga el elemento, hay distintos niveles este en concreto que estoy haciendo yo es del bloque s.
QuimiTris
-Lo que no se es como hacer con los elementos de la primera serie de transición, porque hasta ahora eran pocos elementos los que tenía que aprender, pero ahora son diez … o hago varias reglas nemotécnicas o hago una frase muy larga o hago varias reglas nemotécnicas … Escandinavia tiene vino … pero no puedo continuar … Cristo mantiene la fe como el níquel curado después el zinc …-Un poco forzadas en mi opinión … tienes que buscar una que te salga de manera natural … te lo digo por experiencia, la regla nemotécnica lo que busca es hacerte más fácil el recordar algo, pero cuando lo hace más difícil entonces … no merece la pena.
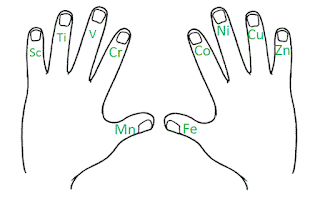
-Ya lo tengo: eScucha Tio Vanidoso Cristo Mantiene la Fe Como Ningún Cura Zangano. Es decir escandio, titanio, vanadio, cromo, manganeso, hierro, cobalto, níquel, cobre y zinc.
- ¿Cómo? repítelo
-eScucha Tio Vanidoso Cristo Mantiene la Fe Como Ningún Cura Zangano
-Bueno … está muy bien, es la que mejor está de todas – dijo su tía satisfecha – como se nota que no vas a un colegio religioso. Bueno ahora repíteme las reglas que te acabas de inventar para que no se te olviden.
-Bebe CocaCola Natural o Fría; es decir boro, carbono, nitrógeno y oxígeno. Flúor Claramente Bromea con Yodo; es decir flúor, cloro, bromo y yodo. eScucha Tio Vanidoso Cristo Mantiene la Fe Como Ningún Cura Zangano. Es decir, escandio, titanio, vanadio, cromo, manganeso, hierro, cobalto, níquel, cobre y zinc.
-Otra vez
-Bebe CocaCola Natural o Fría; es decir boro, carbono, nitrógeno y oxígeno. Flúor Claramente Bromea con Yodo; es decir flúor, cloro, bromo y yodo. eScucha Tio Vanidoso Cristo Mantiene la Fe Como Ningún Cura Zangano. Es decir, escandio, titanio, vanadio, cromo, manganeso, hierro, cobalto, níquel, cobre y zinc.
-Lo bueno de esta última es que puedes usar las dos manos para aplicarla, ya que son diez elementos y tienes cinco dedos en cada mano.
-Si eso es cierto, una mano para Bebe CocaCola Natural o Fría y dos manos para eScucha Tio Vanidoso Cristo Mantiene la Fe Como Ningún Cura Zangano.
-Muy bien, Sonia Fernández Vidal escribió un libro que se llama Desayuno entre partículas para explicar la física cuántica – dijo su tía riendo – nosotras le podemos plagiar el título y llamarle al nuestro Desayuno con la tabla periódica.
-Ah, pero ¿Se puede explicar la física cuántica de una manera sencilla? Todo eso parece muy complejo.
-Bueno, hay que echarle un poco de imaginación, pero ella lo consigue … Bueno, dejémonos de física cuántica … que eso no viene ahora, tenemos que repasar que vamos a un buen ritmo y no conviene perderlo … vamos a recoger, a fregar y nos vamos a poner a ello.
-Vale – contestó Elena
Al cabo de un rato ya estaban en la sala repasando, Adriana esperaba que las reglas que se acababa de inventar Elena fuesen útiles y le ayudasen a hacer bien los ejercicios.
-Bueno a ver, Elena, vamos a ver si esas reglas que te acabas de inventar son útiles vas a sacar la configuración d del ión hierro (III), del ión níquel (II) y del ión cobre (II).
- ¡Empezamos fuerte!, ya con iones, no me gustan nada los iones es lo más difícil para sacar configuraciones electrónicas.
-Precisamente por eso, mar en calma no hizo marinero experto, si no navegas por mares en tormenta y cuando hay oleaje fuerte es imposible que llegues a ser un buen marinero y seguirás siendo un principiante.
- ¡Ya empezamos con analogías que no vienen a cuento!, está bien lo haré, que además fijo que como es difícil la profesora lo pregunta en el examen …
-Vienen más a cuento de lo que crees
Entonces Elena se puso a hacer los ejercicios que le había mandado su tía, cuando acabó se los enseñó y ella se los corrigió.
-A ver Elena ¿Se puede saber por qué has puesto que el hierro (III) es un d3? – Adriana sabía perfectamente porque lo había puesto, pero quería ver si se daba cuenta ella sola, ya que ese fallo lo había cometido en los otros dos ejercicios.
- eScucha Tio Vanidoso Cristo Mantiene la Fe, en estado neutro sería un d6, pero como está en forma de ión hay que arrancar tres electrones … ya que es un catión.
-Vale muy bien, todo lo que acabas de decir está bien y no te lo discuto, sólo un pequeño detalle ¿De dónde hay que arrancar electrones?
-Se empieza por la capa más externa … ¡Ah claro, tengo que arrancar primero los s y después los d! Entonces sería un d5, porque arrancas primero dos electrones de la capa s y un electrón de la capa d, porque es 4s23d6.
-Correcto, para que eso no te vuelva a ocurrir, te recomiendo que lo escribas como 3d64s2, así ya te das cuenta de que tienes que arrancar primero los electrones s y después los d. Pero eso te das cuenta con la experiencia a base de practicar y de hacer ejemplos, ya sé que vas a seguir escribiéndolo unas cuantas veces más del otro modo y te vas a dar cuenta y lo vas a tachar hasta que te salga automáticamente, porque eso nos pasó a todos. Sabe más el diablo por viejo que por diablo. Bueno ahora vas a corregir los otros que hiciste, porque pones que es níquel (II) es un d6 y que el cobre (II) es un d7 y vas a hacer también titanio (IV) y cromo (III).
-Vale para el níquel (II) sería eScucha Tio Vanidoso Cristo Mantiene la Fe Como Ningún en estado neutro sería un d8, pero como arrancas primero los electrones s, al ser estado de oxidación +2, seguiría siendo un d8 ya que arrancas sólo dos electrones que están en el orbital s.
-Muy bien, ahora los que te quedan intenta hacerlo de cabeza sin seguir todos los pasos … que en un examen es importante hacerlo bien, pero también es importante la rapidez.
-Cobre (II) es un d9, titanio (IV) es un d0, y cromo (III) es un d3.
-Muy bien, ahora quiero que hagas una pequeña reflexión antes de pasar a otra cosa. Si te fijas cuando el estado de oxidación del catión es +2, la configuración d sigue siendo la misma que si el elemento estuviera en estado neutro.
-Si ya me he dado cuenta, de hecho, luego el cobre (II) lo hice así.
-Chica lista, pero eso te lo dio la experiencia, después de haberte enfrentado a una situación así después te fue más fácil navegar.
-Sí, supongo que se puede explicar así.
-En el caso del titano (IV), si siguieses haciendo las configuraciones electrónicas mal lo habrías echo bien de casualidad ya que en estado neutro es un d2, entonces habrías empezado arrancando de la capa d y te habrías dado cuenta de un d-2no tiene sentido entonces habrías seguido arrancando de la capa s.
-Sí, supongo …
-En este, lo que quiero que te des cuenta, es que es uno de los peores ejemplos que se puede poner para hacer configuraciones d en un inicio, y puede resultar confuso.
-Ah ya …
-Bien ahora vamos a otra cosa, vamos a repasar estructuras de Lewis y geometría de moléculas, y vas a hacer la estructura de Lewis del amoníaco.
-Mm vale – contestó Elena
Entonces Elena empezó a razonar, amoníaco es NH3, Bebe CocaCola Natural O Fría, entonces el nitrógeno tiene tres electrones, cada hidrógeno tiene un electrón entonces son tres electrones más. El número total de electrones de la estructura es 6, colocas el nitrógeno en el medio con tres electrones. Colocas cada hidrógeno alrededor con un electrón, unes con rayitas y quedan los enlaces. Hay tres pares de electrones alrededor del nitrógeno, y cero pares solitarios por tanto es plana trigonal. Entonces ahí a Elena le saltó la alarma, sabía de sobra que el amoníaco era piramidal, que no era plana …
-Tía, me sale una cosa muy rara en la estructura del amoníaco, este procedimiento no sirve.
-A ver Elena, esta teoría de enlace para casos complicados tiene limitaciones y no se puede usar, la teoría de enlace más avanzada que se ha desarrollado es la teoría de orbitales moleculares, que hasta llegar a la universidad no se da. Pero ese ejemplo, es realmente sencillo, entonces se puede aplicar la teoría de Lewis y la teoría de los pares electrónicos de la capa de valencia. Déjame adivinar, ¿Te sale que el amoníaco es trigonal-plana? ¿no?
- ¿Cómo lo sabes? ¿Si aún no miraste lo que escribí?
-Bueno como te he dicho antes, sabe más el diablo por viejo que por diablo, y porque ya nos conocemos. A ver mira la tabla periódica, no te estás olvidando de sumar los electrones s del nitrógeno.
-Ah, claro …
-Elena, en el examen te dejan la tabla periódica, con agujeros eso sí. Pero puedes darte cuenta mirándola de los electrones s, los p ya los sacas de la regla Bebe CocaCola Natural O Fría. Esto último lo hiciste bien, o que no hiciste bien fue lo primero, así que ahora hazlo bien a ver que te sale.
-Vale.
Elena repitió el procedimiento anterior, pero teniendo en cuenta los electrones s, entonces, el nitrógeno tenía cinco electrones, al unirlo a los tres hidrógenos sobraba un par electrónico, era una estructura del tipo AB3E por tanto la molécula era piramidal, y eso ya concordaba con lo que Elena sabía.
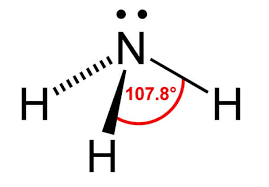
-Muy bien, sólo un comentario, en este caso te diste cuenta porque sabías que el amoníaco era piramidal, que, si no llegas a saberlo, no te habría saltado la alarma. Pero, por ejemplo, si hicieses el borano, es decir BH3 … te daría que el boro tiene sólo un electrón, pero cada hidrógeno tiene un electrón, entonces, ¿Cómo comparten electrones el boro y el hidrógeno? ¿Entiendes lo que te quiero decir? Te darías cuenta de que algo raro pasa y sospecharías que te faltan dos electrones, y de una manera u otra caerías en que los electrones que te faltan son los electrones s.
-Sí supongo que si …
-Un último comentario que te quiero hacer, que, aunque a este nivel todavía no dais estructuras de Lewis de aniones tipo sulfito, fosfito etcétera, es que otro compuesto con “trampa” del estilo del amoníaco sería el sulfito, SO32-, si lo haces sin darte cuenta de los electrones s te saldría que es trigonal-plana, cuando realmente es piramidal, estilo el amoníaco …
-Ah …
-Bueno esto es todo por hoy, a la noche repasamos más ejemplos y mañana ya nos ponemos con otra cosa … pero creo que este tema ya lo tienes dominado … que los electrones s después de haber caído ya varias veces, te vas a dar cuenta a partir de ahora ¡Cuidado con las reglas que ese es el peligro que tienen!
-Si bueno, esperemos ¡Dios, cuanto hay que sufrir para poder aprobar!
-Bueno ¡No te quejes que aún eres joven! – dijo su tía riéndose – a ver Elena, mar en calma no hizo marinero experto ¿Acaso no ves que los deportistas entrenan muchas horas a diario por ejemplo? ¿O qué el descubrimiento del Bosón de Higgs llevó detrás muchas horas de trabajo por parte de los científicos y las científicas del CERN? A veces, como en el caso de la penicilina de Alexander Fleming, la suerte influye. Pero también hay que trabajarla, no hay que esperar a la suerte, hay que salir a buscarla.
-No sé a cuento de qué viene todo esto
-Pues, todo esto viene a cuento de que tú estás pretendiendo que te salgan las cosas fácilmente y con el más mínimo esfuerzo y eso en la vida real no es así. Fíjate que tu madre hoy madrugó porque tenía una reunión, si podía haberse levantado a las diez de la mañana y no haber ido a la reunión, pero posiblemente si no lo hubiese hecho no tendría trabajo y hoy a la mañana posiblemente no habríamos podido desayunar las tostadas que desayunamos. Sin el esfuerzo yo no tendría un título de licenciada y tu madre y tu padre tampoco lo tendrían …
-Vale, ya sé por dónde vas, no hace falta que sigas … y sí, es cierto que quiero que la profesora de química ponga un examen fácil, pero porque no me gusta esa asignatura.
-Elena, a mí no me gustaba la filosofía, es decir, la filosofía me gustaba. Lo que no me gustaba era estudiarla, y tuve que sudar porque la profesora que teníamos no regalaba nada, suspendí muchas veces con un 4,95, si increíble, estás a nada de aprobar y te suspenden pues así fue, tuve que sudar para aprobar. Y los exámenes que nos ponía no eran precisamente fáciles y corregía para abajo. Por no hablarte de muchas experiencias que tuve a lo largo de la carrera.
-Vale, ya llega con el sermón, ya lo entendí.
-Esto hasta que no lo experimentas, no lo entiendes. Recuerda que ningún mar en calma hizo
-Ningún mar en calma hizo marinero experto – completó Elena – ya me quedó claro. Y que no sirve que te cuenten como es, tienes que experimentarlo tú y tropezarte con piedras, en las que no te gustaría tropezar, pero es necesario. Y lo importante es no volver a tropezar.
-Bueno, parece que en teoría algo acabas de aprender, ahora a ver si lo pones en práctica.
Descubrirlaquimica2. Estudiante de química en la USC
23 de Agosto de 2017