 Mecanismos de
reacción
Mecanismos de
reacción y reacciones elementales
Mecanismos de
reacción y molecularidad
Ecuación de
velocidad para una reacción elemental
Ley de las tasas de
reacción y los mecanismos de reacción
Paso de la reacción
que determina la velocidad de la reacción
Mecanismos de
reacción
Mecanismos de
reacción y reacciones elementales
Mecanismos de
reacción y molecularidad
Ecuación de
velocidad para una reacción elemental
Ley de las tasas de
reacción y los mecanismos de reacción
Paso de la reacción
que determina la velocidad de la reacción
Mecanismos de reacción y reacciones elementales
Una ecuación química balanceada es una descripción del resultado general de una reacción química.
Sin embargo tal idealización omite lo que puede suceder en realidad a nivel molecular. Un ejemplo algo grosero de esto es la reacción general de la fotosíntesis y la respiración celular aeróbica, en ambos casos omitiendo una enorme cantidad de pasos intermediarios.
Sin embargo estas no son las excepciones, virtualmente la mayoría de las reacciones descritas en los libros de texto son llevadas a cabo en varias etapas. En las siguientes discusiones hablaremos de algunas reacciones y veremos como la ley de la velocidad de reacción puede darnos información acerca de los pasos en los que se descompone una reacción química neta.

Figura MRR-01. Una ecuación química neta describe productos y reactivos, pero no dice nada sobre los intermediarios de la reacción o de los complejos activados.
Cada uno de los pasos en los que se descompone una reacción química neta se conoce como una reacción elemental “que a su vez no está compuesta por más sub-pasos”.Considere por ejemplo el dióxido de nitrógeno con el monóxido de carbono.
A temperaturas por debajo de los 500°K, esta reacción de fase gaseosa ha sido descrita aproximadamente como explicada mediante el desglose en dos pasos o reacciones elementales.
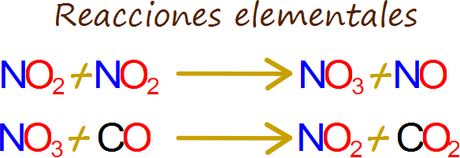
Figura MRR-02. El dióxido de nitrógeno puede ser visto al mismo tiempon como un reactivo y como un catalizador de la reacci
Cada paso se llama reacción elemental, el cual se define como un evento simple, como la colisión entre moléculas que resulta en una reacción. El grupo de reacciones elementales cuyo efecto general es igual al resultado de la reacción neta se denomina mecanismo de la reacción.De acuerdo al mecanismo de reacción dado anteriormente, dos moléculas de dióxido de nitrógeno colisionan y reaccionan para dar el producto molecular llamado monóxido de nitrógeno y el intermediario de reacción trióxido de nitrógeno. Un intermediario de la reacción es una especie producida durante una reacción que no aparece como producto en el resultado de la reacción neta debido a que reacciona inmediatamente en el siguiente paso del mecanismo de la reacción.
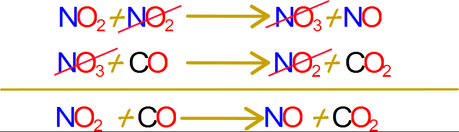
Más aun, los intermediarios de la reacción tienen una existencia limitada y en muchos casos, meramente teórica, es decir no pueden ser aislados de la mezcla en reacción. El trióxido de nitrógeno se conoce solo a través de su espectro electromagnético en la región visible. Este reacciona rápidamente con el monóxido de carbono para dar moléculas como el dióxido de nitrógeno y el dióxido de carbono.
La reacción química general, la cual representa el resultado neto de estas dos reacciones elementales en el mecanismo se obtiene mediante la adición de los pasos y el cancelamiento algebraico de las especies que ocurren a ambos lados de las ecuaciones.
PRINCIPAL
REGRESAR