¿Qué pasa cuando los participantes en un ECA se dan cuenta de que tienen 'el poder'?
A continuación os ofrezco mi traducción de un artículo publicado en BMJ y titulado: Subjets no more: What happens when trial participants realize they hold the power? BMJ 2014; 348 doi: http://dx.doi.org/10.1136/bmj.g368 (Published 28 January 2014)No os quedéis con los datos particulares (de la enfermedad en concreto) sino con las acciones por parte de los usuarios auto-organizados en entornos de investigación cuando menos polémicos... ¿puede estar pasando algo así en nuestro medio?_________________________________________________________________________________
Los pacientes nos pedirán responsabilidad a todos de maneras nuevas e indispensables
El contrato social de los ensayos clínicos está desequilibrado: Los pacientes se adhieren a protocolos arduos, son asignados aleatoriamente al placebo y cegados respecto a su estado de salud. Aunque la mayoría de los participantes (>90%) les gustaría conocer un resumen sencillo de los resultados1, sólo una minoría (<10%) los recibe2, mientras que al resto le queda la opción de pagar 30$ para leer los resultados una vez publicados en una revista de revisión por pares clásica 3. Dichos desequilibrios pueden haber contribuído a un movimiento emergente, sustentado online por "redes de pacientes alimentadas por la investigación 4" en las que los participantes han empezado a desenmascararse sistemáticamente, compartir sus datos, analizar literatura, realizar sus análisis estadísticos y compartir sus hallazgos online.
En 2007, pacientes con esclerosis lateral amniotrófica usaron google para traducir un resumen de conferencia en italiano que sugería que el carbonato de litio podría ralentizar su enfermedad 5. En una publicación titulada "El litio retrasa la profesión de la ELA" 16 pacientes tratados con litio (todos sobrevivieron 15 meses) se compararon con 28 controles (un tercio de los cuales no terminó el ensayo con vida) 6. En los siguientes 6 meses de la publicación del resumen 160 pacientes notificaron haber obtenido litio fuera de indicación y realizado un seguimiento de su progresión usando las hojas interactivas de google y la escala validada ALSFRS-R 7. Un paciente en Brasil y un cuidador en EEUU iniciaron este estudio, planteando la cuestión de hasta donde llegaba la supervisión ética89 .
Nuestra red de pacientes, PatientsLikeMe, ya ha incluido las puntuaciones del ALSFRS-R pero añadiendo el seguimiento de los niveles de litio en sangre, los recordatorios de inclusión de datos y la monitorización por enfermería para vigilar los efectos secundarios conocidos. Hemos presentado datos que indican que el litio fue ineficaz en los nueve meses de ensayo controlado aleatorio 10 publicando los datos del seguimiento a largo plazo con análisis más sofisticados en un artículo de acceso abierto en Nature Biotechnology que incluyó el archivo completo de datos anonimizado como material complementario 11. Cuatro ensayos aleatorizados replicaron nuestros hallazgos negativos 12.
Poco después estaban en marcha dos ensayos aleatorizados sobre medicamentos nuevos: NP001, de Neuraltus (en ensayo Fase II) y la US dexpramipexole de Biogen (Fase III). Los participantes de estos ensayos compartieron datos mientras estaban enrolados formalmente en los protocolos en los que se suponía que estaban cegados y que desconocían su puntuación en ALSFRS-R. Trazaron su progreso, aprovecharon los efectos secundarios conocidos como la neutropenia en un intento de desenmascararse, y usaron estadísticas rudimentarias para analizar la eficacia de ambas mediaciones. Aproximadamente un tercio del grupo de NP001 y un 10% del de la US dexpramipexole registraron sus datos online. Un tercer grupo exprimental se formó cuando algunos pacientes leyeron la patente del NP001 e infirieron que el clorito de sodio (limpiador industrial) podría ser el ingrediente activo. Algunos pacientes que no se enrolaron en el ensayo empezaron a administrárselo por vía oral o intravenosa 13.
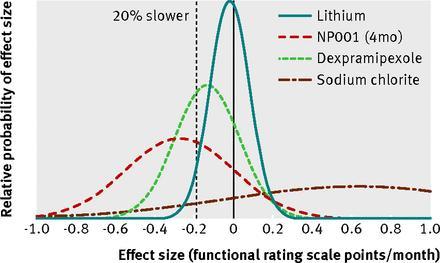
Aunque teníamos datos de menos participantes que para el ensayo sobre el litio, compartimos nuestro análisis de los tres grupos en Figshare en la víspera del desenmascaramiento del ensayo de la dexpramipexole 14 . Con importantes advertencias estimamos que la dexpramipexole estaba por debajo de ofrecer un beneficio clínico 15 y NP001 justo por encima, pero los intervalos de confianza son demasiado grandes como para llegar a una conclusión fiable (figura⇓). El ensayo de la dexpramipexole de Biogen informó de falta de efectividad, mientras que el ensayo fase III de NP001 espera conseguir fondos. Cuando ALSUntangle (web de ayuda a pacientes de ELA http://www.alsuntangled.com/) usó nuestros datos para advertir de los peligros potenciales del clorito de sodio su uso no indicado disminuyó 17.
El concepto de "altruismo científico" puede verse sustituido por el de "maximiza tus opciones de supervivencia". Para bien o para mal, las herramientas digitales permiten una mayor autoformación y diseminación rápida. La consecuencia es que este diseño científico, el consentimiento informado y la vigilancia ética pueden verse cortocircuitadas por la "desobediencia" de los pacientes. Algunas compañías farmacéuticas elegirán compartir los datos de sus ensayos (como sugiere ALLTrials), pero aún si no lo hicieran los datos podrían estar disponibles si los participantes eligen compartir sus datos ellos mismos, algo que se ve reforzado por el acceso de los pacientes a su historia clínica electrónica. Hoy los miembros de PatientsLikeMe informan sobre el seguimiento de sus resultados en unos 400 ensayos. Los pacientes cada vez son más conscientes de que tienen literal y estadísticamente el "poder" en los ensayo y que hay que construir sistemas para corregir los desequilibrios. Si no hacemos nada colectivamente, un estudio fase III podría ser científicamente nulo porque una masa crítica de participantes viola intencionadamente el protocolo en PatientsLikeMe, Facebook o Twitter.
Este puede ser un resultado trágico. Para prevenirlo, proponemos forjar un nuevo contrato social que maximice tanto el descubrimiento científico como la autonomía del paciente, preparando el escenario para ensayos con pacientes más comprometidos. Juntos podemos desarrollar con rigor nuevos métodos para incluir pacientes en tratamientos selecionados, diseño de protocolos, reclutamiento, retroinformación, resumenes sencillos, publicaciones y evaluaciones de valor. Nos sentimos animados por el desarrollo de un "intercambio abierto de investigación" online que permite a los investigadores el acceso rápido a los pacientes para la obtención y validación psicométrica de las medidas de resultado informadas por el paciente 18que ahora requiere la FDA 19 Creemos que los pacientes nos pueden sorprender con su habilidad para identificar los obstáculos para la inclusión en ensayos, priorizar los resultados que verdaderamente tienen valor y ayudarnos a aprender qué funciona en el mundo real, no sólo en los ensayos. Con las nuevas herramientas a su disposición los pacientes nos pedirán responsabilidades de formas nuevas e indispensables. Los pacientes por si mismos ya han puesto las bases, pidámoles seguir construyendo sobre ellos juntos como iguales.
Referecias
- ↵Partridge AH, Winer EP. Sharing study results with trial participants: time for action. J Clin Oncol2009;27:838-9.FREE Full Text
- ↵Cox K, Moghaddam N, Bird L, Elkan R. Feedback of trial results to participants: a survey of clinicians’ and patients’ attitudes and experiences. Eur J Oncol Nurs2011;15:124-9. CrossRefMedline
- ↵Science Direct. Pay per view. http://info.sciencedirect.com/sciencedirect/buying/individual_article_purchase_options/ppv.
- ↵Workman TA. Engaging patients in information sharing and data collection: the role of patient-powered registries and research networks. US Agency for Healthcare Research and Quality, 2013.
- ↵Frost JH, Massagli MP, Wicks P, Heywood J How the social web supports patient experimentation with a new therapy: The demand for patient-controlled and patient-centered informatics. AMIA Annu Symp Proc2008:217-21.
- ↵Fornai F, Longone P, Cafaro L, Kastsiuchenka O, Ferrucci M, Manca ML, et al. Lithium delays progression of amyotrophic lateral sclerosis. Proc Natl Acad Sci USA2008;105:2052-7.
- ↵Cedarbaum JM, Stambler N, Malta E, Fuller C, Hilt D, Thurmond B, et al. The ALSFRS-R: a revised ALS functional rating scale that incorporates assessments of respiratory function. J Neurol Sci 1999;169:13-21.CrossRefMedlineWeb of Science
- ↵O’Connor D. The apomediated world: regulating research when social media has changed research. J Law Med Ethics2013;41:470–83.MedlineWeb of Science
- ↵Vayena E, Tasioulas J. Adapting standards: ethical oversight of participant-led health research. PLOS Med2013;10:e1001402.CrossRefMedline
- ↵Wicks P, Massagli M, Frost J, Macedo H, Felzer K, Heywood J A patient-led trial of lithium in ALS using the internet. Amyotroph Lateral Scler2008;9:S59.
- ↵Wicks P, Vaughan TE, Massagli MP, Heywood J. Accelerated clinical discovery using self-reported patient data collected online and a patient-matching algorithm. Nat Biotechnol2011;29:411-4. CrossRefMedlineWeb of Science
- ↵Armon C. Is the lithium-for-ALS genie back in the bottle? Not quite. Neurology2010;75:586-7. CrossRef
- ↵Dokser Marcus A. Frustrated ALS patients concoct their own drug. Wall St Journal 2012 Apr 15. http://online.wsj.com/news/articles/SB10001424052702304818404577345953943484054.
- ↵Heywood J. Waiting for P<0.05. Figshare2012. http://dx.doi.org/10.6084/m9.figshare.96802
- ↵Castrillo-Viguera C, Grasso DL, Simpson E, Shefner J, Cudkowicz ME. Clinical significance in the change of decline in ALSFRS-R. Amyotroph Lateral Scler 2010;11:178–80. CrossRefMedlineWeb of Science
- ↵Cudkowicz ME, van den Berg LH, Shefner JM, Mitsoumuto H, Mora JS, Ludolph A, et al. Dexpramipexole versus placebo for patients with amyotrophic lateral sclerosis (EMPOWER): a randomised, double-blind, phase 3 trial. Lancet Neurol 2013;12:1059-67.CrossRefMedlineWeb of Science
- ↵ALSUntangled Group. ALSUntangled No 19: Sodium chlorite. Amyotroph Lateral Scler Frontotemporal Degener2013;14:236-8. Medline
- ↵Wicks P, Heywood B, Heywood J. Online platform to accelerate patient involvement in open instrument development. Qual Life Res 2013;22:1-137.Web of Science
- ↵Gnanasakthy A, Mordin M, Clark M, DeMuhro C, Fehnel S, Copley-Merriman C. A review of patient-reported outcome labels in the United States: 2006 to 2010. Value Health2012;15:437-42. CrossRefMedlineWeb of Science


