 Tenemos la creencia que los compuestos organohalogenados son creados por los humanos y no se encuentran en la naturaleza. Nada más lejos de la realidad, en la naturaleza encontramos organofluorados, organoclorados, organobromados y organoyodados.
Tenemos la creencia que los compuestos organohalogenados son creados por los humanos y no se encuentran en la naturaleza. Nada más lejos de la realidad, en la naturaleza encontramos organofluorados, organoclorados, organobromados y organoyodados.
Algunos de los organoclorados que sintetizamos los humanos ya llevan los seres vivos sintetizándolos durante millones de años y nosotros sólo los hemos tomado como ejemplo. También encontramos organobromados y organoyodados (hormona tiroidea por ejemplo en humanos). En el caso de los organofluorados, son muy pocas las especies que utilizan el enlace C-F, encontrando actualmente unos 30 compuestos naturales organofluorados, 5 de los cuales son sintetizados por plantas y animales.
Debido a que el flúor es el elemento más electronegativo de todos los elementos, la propiedad general de una molécula dada se puede cambiar en gran medida introduciendo átomos de flúor en su estructura. Además, el radio atómico del flúor es similar al del hidrógeno, por lo que el tamaño de la molécula no se ve afectado. El flúor es el decimotercer elemento más abundante en la corteza terrestre, siendo el halógeno más abundante. Con este pretexto es notable que la naturaleza no haya desarrolló una importante bioquímica explotando el flúor. Los compuestos organoclorados están muy extendidos ya que en el medio marino, junto con los organobromados, son muy comunes.
Se han aislado muchos menos productos naturales yodados, lo que puede ser debido a los problemas asociados con el aislamiento químico de productos naturales con el enlace carbono-yodo.
Los compuestos organofluorados son extremadamente escasos en la biosfera y solo se han identificado cinco, más una serie de ácidos grasos co-fluorados de cadena larga, existiendo en total unos 30 compuestos organofluorados en la biosfera.
La naturaleza insoluble de muchos minerales que contienen flúor hace que el elemento no esté biológicamente disponible. Por lo tanto, mientras que el agua de mar tiene sobre 1900 ppm de cloruro, las concentraciones de fluoruro son alrededor de 1,3 ppm. Para que el flúor pueda estar involucrado en procesos bioquímicos, el fluoruro disponible debe volverse reactivo.
El anión fluoruro es un nucleófilo relativamente pobre y en el agua está muy hidratado, lo que compromete aún más su nucleofilicidad. Los otros halógenos se pueden activar fácilmente para la química electrofílica por oxidación catalizada por haloperoxidasa con peróxido de hidrógeno a los correspondientes iones de halonio (Cl+, Br+ e I+). Sin embargo, el alto potencial rédox necesario para la oxidación a F+ impide la incorporación de flúor a los productos naturales por esta vía. Por lo tanto, el mecanismo de formación de enlaces C-F en los pocos organismos capaces de esta hazaña bioquímica desafiante es científicamente intrigante y también de potencial importancia biotecnológica.
Organofluorados
Los compuestos que contienen flúor son muy útiles. El flúor es capaz de unirse a prácticamente todos los elementos de la tabla periódica, incluso a los gases nobles. En la naturaleza el flúor se presenta en forma de minerales inorgánicos como fluorita (CaF2) y criolita (Na3AlF6).
Los compuestos que contienen flúor se encuentran en áreas tan familiares como el teflón (ver entrada El teflón y el colesterol) de las sartenes y utensilios de cocina antiadherentes. Por no decir de los CFCs, o clorofluorocarbonos, que se usaron en el pasado hasta su prohibición por ser muy dañinos para la capa de ozono (en la actualidad se utilizan alternativas menos dañinas a los CFC, los HCFC o hidroclorofluorocarbonos).
Tampoco tenemos que olvidarnos de los medicamentos que contienen flúor, como la nitisinona (utilizado para tratar una enfermedad rara), que aunque no se extraiga de las plantas directamente, si que es un análogo de la leptospermona, un herbicida natural. También el prozac tiene flúor en su estructura.
En los seres vivos, los compuestos organofluorados son extremadamente raros. Los enlaces C-F son muy fuertes y tienen algunas propiedades únicas, pero la madre naturaleza no parece haberlos utilizado tanto. Aún así, se han descubierto hasta la fecha unos 30 compuestos naturales que contienen enlaces C-F (frente a los 2150 organoclorados, 1850 organofluorados y 95 organoyodados) [1].
Organofluorados naturales
La lista de compuestos organofluorados naturales no es muy amplia, unos 30, como he comentado antes. Destacan el ácido monofluoracético, el ácido ω-fluoroleico y compuestos derivados, fluoroacetona, nucleocidina, 5-fluorouracilo y sus derivados y la 4-fluorotreonina. Vamos a ver cada uno de ellos.
Ácido monofluoroacético y fluoroacetatos
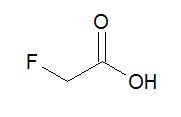
La cantidad de ácido monofluoracético que contiene la Dichapetalum cymosum en sus hojas es de 250 ppm, mientras que las hojas jóvenes y semillas de Dichapetalum Braunni tienen entre 7200 y 8000 ppm de este compuesto, respectivamente, siendo el concentraciones más altas reportadas hasta ahora. En las semillas y tallos de flores de Palicourea margravii, que crece en Brasil, se ha demostrado que acumula hasta 5000 ppm de la toxina.
El ácido fluoracético tiene efectos graves en el sistema nervioso central de los mamíferos causando convulsiones tetánicas y ataques cardíacos fulminantes. Su toxicidad se debe al bloqueo del ciclo del ácido tricarboxílico (ciclo de Krebs) causado por la combinación del ácido monofluoracético con el acetil-CoA, formando fluoroacetil-CoA y luego a (2R, 3R) -fluorocitrato, que es la única forma tóxica de fluorocitrato (los tres estereoisómeros restantes son inofensivos).
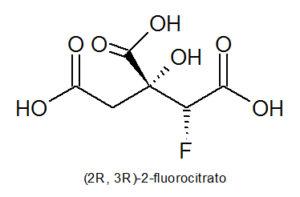

Un problema añadido es que es un compuesto soluble en agua, sin olor ni sabor, lo que lo hace si cabe más peligroso. Además, los cuerpos de las criaturas envenenadas con el compuesto 1080 siguen siendo venenosos hasta un año después.
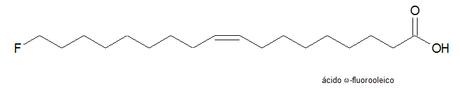
Ácido ω-fluoroleico y compuestos derivados
En las semillas de la Dichapetalum toxicarium, además de encontrar ácido fluoracético se encontró que contenían varios ácidos grasos fluorados, siendo el ácido 18-fluoroleico (ω-fluoroleico) el más abundante.
Otros encontrados son el ácido 16-fluoropalmítico, ácido 10-fluorocáprico, ácido 14-fluoromiristico y ácido 18-fluoro-9R,10R-dihidroxiestearico (que se cree que es un metabolito del ácido 18-fluorooleico). Estos compuestos también son muy tóxicos para los mamíferos ya que se metabolizan a ácido ofluoracético.
Además, otros seis ácidos grasos fluorados, más tarde se encontraron en el aceite de la semilla de la misma planta los siguientes compuestos: ácido 20-fluoroaraquidónico, ácido 20-fluoroeicosenoico, ácido 18-fluorolinoleico, ácido 16-fluoropalmitoleico, ácido 18-fluoroesteárico y ácido 18-fluoro-9,10-epoxiesteárico. Se cree que estos ácidos grasos fluorados son biosintetizados por las plantas del género Dichapetalum.
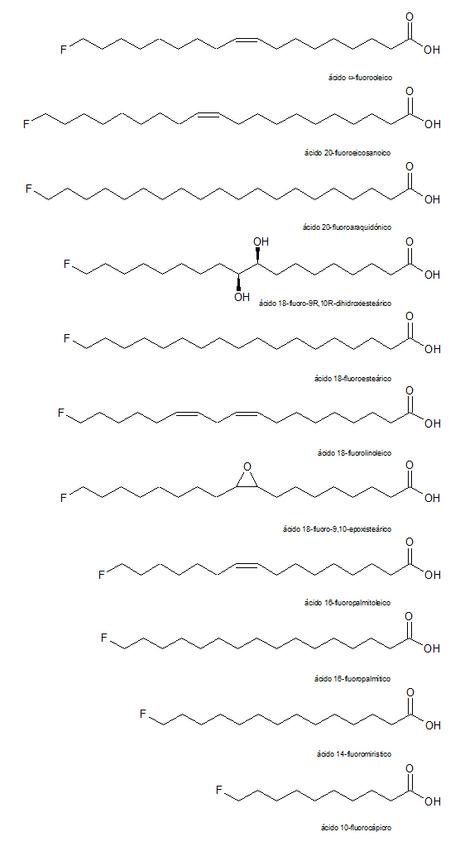
Estos componentes lipídico fluorado constituyen más o menos el 3% del aceite de semilla, siendo el ácido ω-fluorooleico el más abundante, con un 80% del flúor orgánico presente. No hay evidencia de que el flúor se incorpore en la mitad de la cadena en ninguno de estos lípidos.
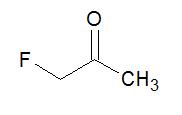
Fluoroacetona
Nucleocidina
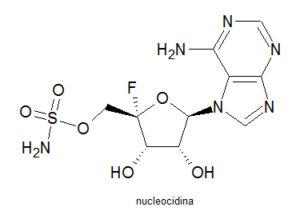
Hasta hace relativamente poco, aparte de las plantas superiores, los únicos organismos conocidos capaces de elaborar un compuesto fluorado eran las bacterias Streptomyces calvus. Este antibiótico fue aislado por primera vez de la Streptomyces calvus en 1957, pero no fue hasta 1969 cuando se detectó que el compuesto tenía flúor. Posteriormente, en 1976, se confirmó la estructura.
4-fluorotreonina
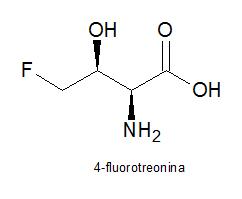
La 4-fluorotreonina es el único aminoácido natural fluorado conocido. Cuando se aisló la 4-fluorotreonina se predijo que la estereoquímica sería análoga a la L-treonina. Recientemente se ha confirmado la estructura de la 4-fluorotreonina por síntesis asimétrica, demostrando que la 4-fluorotreonina natural tiene la configuración (2S, 3S).
Organofluorados en animales
Además de plantas y microorganismos, también se ha descubierto un animal marino que es capaz de producir compuestos organofluorados. En 2003 se investigó la esponja marina Phakellia Fusca Schmidt [5], obtenida de el Mar de China Meridional y se encontró que este organismo era capaz de producir cinco alcaloides derivados del 5-fluorouracilo, incluyendo los conocidos agentes antitumorales, 5-fluorouracilo (compuesto 1), y 1- (2-hidroxietil)-5-fluorouracilo (compuesto 2).
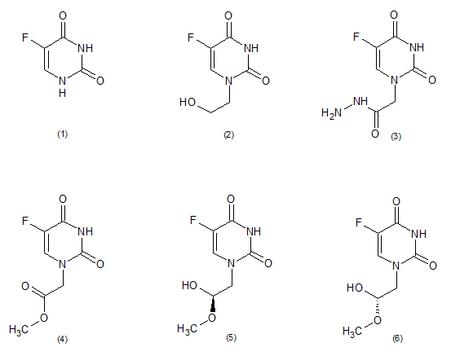
Sin embargo, Estudios posteriores concluyeron que estos compuestos no pueden derivarse de la síntesis biológica y se cree que pueden ser más bien el resultado de la contaminación industrial. A pesar de esta incertidumbre, este estudio [3] fue el primero en informar de la existencia de compuestos organofluorados en animales marinos. En ningún otro animal conocido han sido reportados compuestos organofluorados.
Otros compuestos naturales fluorados
Flúor elemental natural

La antozonita, también conocida como fluorita fétida, es una variedad de fluorita radioactiva que se encontró por primera vez en Wölsendorf, Baviera, en 1841, y se caracteriza por la presencia de múltiples inclusiones que contienen flúor elemental. El mineral es un tipo de fluorita (CaF2) que contiene uranio radiactivo y era bien sabido que libera un olor acre cuando aplastas la roca.
Según los grupos de investigación alemanes, la descomposición nuclear del uranio genera nucleidos hijos y algunos de ellos emiten radiación ionizante y, por lo tanto, se separan la fluorita en calcio y flúor elemental. El flúor permanece en inclusiones diminutas separado del calcio por la fluorita no reactiva y así retiene su forma elemental. La radiación ionizante también conduce a la formación de cúmulos de calcio, que le dan a la “antozonita” su oscuridad y color. Cuando los cristales se trituran o rompen, se libera el flúor elemental.
Otros compuestos naturales de flúor
En la naturaleza se han encontrado algunos compuestos inesperados que contenen flúor. Por ejemplo, se han encontrado compuestos como el tetrafluoruro de carbono, el tetrafluoroetileno (con el que se hace el Teflón®) o el triclorotrifluoroetano (más conocido como Freon 113). Estos compuestos no son escapes de la actividad industrial y existen de forma natural. Sin embargo, no son biosintetizados por organismos vivos, pero se cree que se forman a partir de las reacciones entre gases volcánicos que contienen flúor y compuestos orgánicos en condiciones de alta temperatura. Hay bastantes ejemplos en los que los compuestos que antes se pensaba que eran puramente artificiales, también existen en la naturaleza, y este es un ejemplo perfecto.
También vale la pena mencionar es que el ácido trifluoroacético a veces se detecta en el agua de lluvia en ciertas concentraciones. Se sugiere que las concentraciones sean demasiado altas para ser explicadas como provenientes de fuentes artificiales. La pregunta de dónde vino aún no se ha respondido.
Referencias y fuentes de datos
[1] Naturally Occurring Organofluorines
[2] Intoxicación por fluoroacetato de sodio
[3] 5-Fluorouracil Derivatives from the Sponge Phakellia fusca
[4] First direct evidence that elemental fluorine occurs in nature
[5] Antozonite (Var: Stink-Fluss)
Natural and engineered biosynthesis of fluorinated natural products
Dictionary of Marine Natural Products
