 Pares ácido y base
conjugada
Pares ácido y base
conjugada
Otro fenómeno que emerge de la nueva definición acido-base es la unión del concepto de ácido y de base. En Arrhenius aunque ambos conceptos se relacionaban a través del agua, eran relativamente independientes, pero en Bronsted-Lowry TODO OCURRE EN UNA MISMA REACCION, es por esto que nos referimos a un par inextricablemente unido llamadas reacción ácido-base.
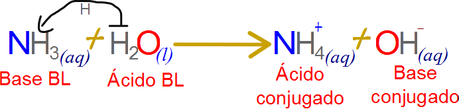
Una consecuencia de esto es que una vez se transfiere el protón de un donante a un receptor las definiciones de las especies químicas, quien fuera el ácido se convierte en una base y quien fuera una base se transforma en un ácido.
¿Sin embargo de ser así nos asaltaría la pregunta de porque no ocurre la reacción inversa?, la respuesta es que algunas veces ocurre pero ese problema lo discutiremos con el equilibrio ácido/base.
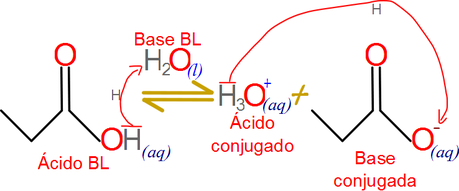
Por otro lado, los ácidos que se disocian totalmente. son llamados fuertes, pero cuando pierden su protón se transforman en una base, una muy débil que no es capaz de fungir adecuadamente como un aceptor de protones a su vez, por lo que la reacción inversa no ocurre.
Una razón mucho más específica es la termodinámica, la reacción de perdida de protones por un ácido fuerte emite grandes cantidades de energía y esto puede ser fácilmente palpable cuando se disuelve un ácido en agua. Sin embargo poder aceptar un protón por una base débil no se favorece termodinámicamente y requiere energía para darse.
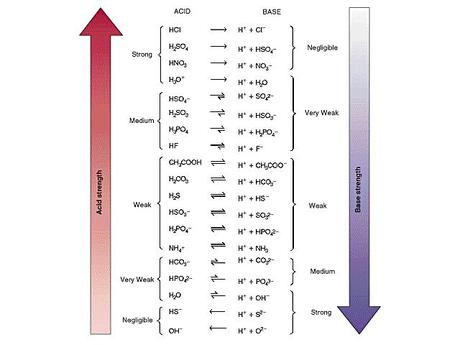
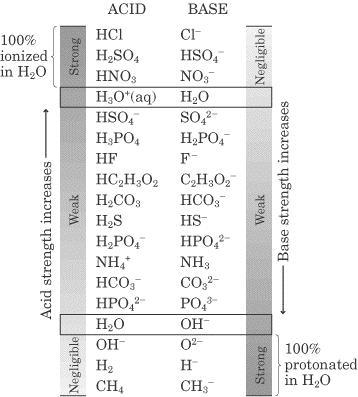
Figura PAB-01. Esta tabla representa las parejas ácido base con su respectiva fuerza, notese que los ácidos fuertes generan bases muy débiles y las bases fuertes generan ácidos muy débiles. Por el contrario los ácidos débiles generan bases débiles en un estado de equilibrio y viceversa.
PRINCIPAL REGRESAR