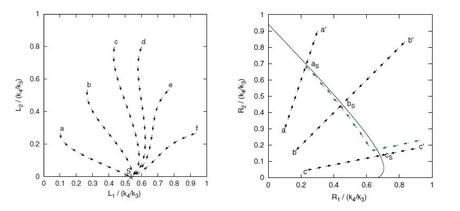
(Izquierda) Auto-catálisis contra (derecha) replicación con herencia en términos de cinética: En el caso de autocatálisis, todos los estados iniciales finalmente llevaron al mismo estado estacionario. En el caso de la replicación con herencia, los estados iniciales llevaron a a distintos estados estacionarios en la curva de estado estacionario. Las flechas azules muestran que el movimiento a lo largo de la curva de estado estacionario es una lenta marcha hacia el incremento de la replicasa más activa, R2. Crédito de la imagen : Doriano Brogioli. ©2010 The American Physical Society.
En el campo de la abiogénesis, los científicos actualmente investigan varias formas en las que la vida podría haber surgido a partir de la materia inerte. Generalmente, cualquier teoría de la abiogénesis debería tener en cuenta dos aspectos importantes de la vida: la replicación (la capacidad de transmitir mutaciones a su descendencia) y el metabolismo (las reacciones químicas requeridas para actividades vitales tales como romper el alimento). Aunque estas dos características ayudan a proporcionar una definición de trabajo para la vida, más recientemente los científicos han enfatizado la importancia de otra característica clave requerida por la evolución Darwiniana: la selección, o la replicación de las mutaciones que proporcionan una ventaja evolutiva.
“El problema básico de la abiogénesis es encontrar la primera entidad viva que se generó a partir de la materia inerte”, dice Doriano Brogioli, físico de la Universidad de Milán-Bicocca, a PhysOrg.com. “Pero, ¿cuál es la definición de la vida: es la replicación, o el metabolismo, o simplemente la auto-catálisis? Creo que no es simplemente una cuestión de definición: lo que es necesario es “evolución”, incluso si la entidad que sufre (o realiza) la evolución no es una entidad viva clásica. Una vez que empieza la evolución, puede alcanzar estructuras de cualquier complejidad: a partir de una célula, la evolución crea árboles, pájaros, ballenas, hormigas y todo el actual prodigio que es el mundo vivo”.
Los sistemas puramente químicos pueden poseer la capacidad de replicarse y metabolizar, pero los científicos han encontrado que los sistemas químicos no pueden realizar selección por sí mismos; las moléculas más activas no se replican más que otras, y las mutaciones individuales útiles no se heredan a la descendencia. Por tanto, los investigadores han sugerido que probablemente se requiere algún tipo de proceso físico para introducir la competición entre los sistemas químicos y generar la presión selectiva requerida para la evolución.
“Se necesitan tres características para la evolución: herencia, mutación y selección”, dice Brogioli. “Las moléculas simples pueden replicar otras moléculas, incluyendo copias de sí mismas, y pueden sufrir mutaciones. Pero en una solución con replicasas, cada una de ellas repite lo que encuentre, incluyendo moléculas no activas o replicasas menos activas. No está activa la selección. La razón es que la química (tradicional) favorece a las moléculas egoístas: la molécula que es más probable que se replique incrementa su concentración. Para que la selección tenga lugar, debe haber un proceso físico. La confinación mediante membranas es la forma actual usada por los organismos vivos. Pero es difícil creer que una estructura compleja como una célula pueda formarse espontáneamente, dado que los polímeros de replicación deben formarse junto con las propias membranas. Este problema se encuentra en todas las teorías de abiogénesis, incluyendo el mundo de ARN y las teorías de primero metabolismo”.
Brogioli ha adoptado una aproximación única para satisfacer los requisitos de selección proponiendo que la respuesta puede estar en las fluctuaciones termodinámicas. Estas fluctuaciones, que son cambios en el número de moléculas en un volumen dado debido a los movimientos térmicos, puede permitir que la selección se haga efectiva, llevando al incremento de las moléculas con una ventaja evolutiva. Investigando algunos sistemas químicos que poseen una característica a la que llama “estabilidad marginal química”, Brogioli ha demostrado que las fluctuaciones termodinámicas inducen no sólo un camino aleatorio, sino una deriva dirigida hacia el incremento de la eficiencia en la replicación.
Brogioli sugiere que esta deriva representa una forma inicial de evolución que tuvo lugar antes de que las membranas empezaran a englobar sistemas químicos; tras esta época, las membranas habrían asumido la responsabilidad de definir entidades en competición entre sí, permitiendo que tuviese lugar la selección. Si las fluctuaciones termodinámicas desempeñaron un papel en la selección de la vida inicial, se solventaría el problema del requisito de que surjan a la vez los replicantes químicos y las membranas que los encierran.
En su artículo, Brogioli mira a la replicación desde una perspectiva cinética, en la cual el homólogo cinético de la herencia de mutaciones es la presencia de múltiples estados estacionarios, es decir, distintas líneas de mutación pueden estar presentes a la vez, y su descendencia hereda las mutaciones. Demuestra que los sistemas químicos que son capaces de pasar mutaciones a su descendencia pueden imaginarse como sistemas con múltiples estados estacionarios, dando de esta forma la propiedad de la estabilidad química marginal. Estos sistemas difieren de un sistema “auto-catalítico” simple (por ejemplo, un sistema químico puro) en que simplemente produce descendencia sin transmitir mutaciones; el homólogo cinético serían estados iniciales que todos llevarían a un estado estacionario.
Como analogía de un sistema marginalmente estable, Brogioli considera el ejemplo mecánico de una canica en una superficie plana, donde cualquier punto de la superficie es un punto estacionario. Si se perturba la canica, alcanza un punto estacionario distinto en lugar de retornar a su posición original, dado que no hay fuerza de restauración. De la misma forma, fluctuaciones de concentración espontánea pueden permitir que un sistema químico herede una variedad de mutaciones a partir de su sistema padre, y cualquiera de estas mutaciones puede considerarse como estable.
Brogioli descubrió el movimiento de deriva estudiando matemáticamente las fluctuaciones termodinámicas a lo largo del tiempo. Encontró que, si hay presentes dos replicasas R1 y R2, la replicasa más eficiente, digamos R2, empieza a incrementar su número y hacerse dominante. En volúmenes con una mayor concentración de R2, tendrá lugar más replicación, y habrá una fracción aún mayor de R2. Después, puede surgir una replicasa incluso más eficiente debido a mutaciones aleatorias, y su concentración aumentará, y así continuamente.
Por el momento, la deriva se ha confirmado únicamente mediante cálculos numéricos, y debe considerarse aún como teoría. Brogioli señala que la mayor parte de los sistemas químicos que tienen una replicasa no poseen estabilidad marginal química, y por tanto no se ven afectados por las fluctuaciones termodinámicas. No obstante, su estudio demuestra que es posible la existencia de un sistema químico que es marginalmente estable y puede pasar por una evolución espontánea. Investigar estar teoría podría llevar a revelaciones muy importantes. La demostración de un sistema químico marginalmente estable en el laboratorio no sólo sería el primer experimento en el que un sistema químico sufre una evolución espontánea, sino también el primer modelo in vitro de reacción química que lleva a la vida.
“Actualmente, no se ha creado ninguna replicasa que pueda auto-mantener su replicación, pero la replicación de polímeros de ARN pueden obtenerse mediante la unión de oligonucleótidos cortos”, dice Brogioli. “Esta es una forma [de encontrar un sistema químico que podría tener estabilidad marginal]. Otra posibilidad es crear un sistema más abstracto, en el cual la replicación se logre mediante una enzima, y la actividad de la enzima se vea afectada por la presencia de uno de los polímeros replicados. Obviamente, esto es sólo una prueba de concepto de la estabilidad marginal y la deriva evolutiva, pero no es una reproducción realista del origen de la vida. La posibilidad más interesante es considerar las reacciones propuestas por las teorías de primero metabolismo. En esas teorías, ningún polímero replicante estuvo implicado en la abiogénesis, sino sólo pequeñas moléculas que constituyen algún tipo de red metabólica. El objetivo es encontrar una reacción muy simple que pueda ser marginalmente estable”.
Más información: Doriano Brogioli. “Marginally Stable Chemical Systems as Precursors of Life.” Physical Review Letters 105, 058102 (2010). DOI: 10.1103/PhysRevLett105.058102
Artículo traducido y posteado en Ciencia Kanija, el original se publicó en Physorg, su autora es Lisa Zyga.
