Introducción
Los criterios que definen la preeclampsia no han cambiado en las últimas décadas. Estos son: aparición a partir de la 20ª semana de gestación; proteinuria de 24 horas ≥30 mg/día o, si no está disponible, una concentración ≥30 mg (≥1 con varilla graduada) en un mínimo de 2 muestras de orina recogidas al azar con un intervalo de por lo menos entre 4-6 horas pero de no más de 7 días, una presión arterial sistólica de 140 mm Hg o una presión arterial diastólica ≥90 mm Hg registradas en 2 oportunidades utilizando un manguito adecuado, con una separación de 4-6 horas pero inferior a 7 días y, desaparición de todas estas anormalidades antes de la finalización de la sexta semana después del parto. Sin embargo, también deben ser consideradas como posible preeclampsia algunas presentaciones de la hipertensión arterial relacionada con el embarazo combinadas con anormalidades clínicas o de laboratorio o, con la restricción del crecimiento intrauterino.
Epidemiología
La preeclampsia es un trastorno multisistémico que en los países occidentales complica al 3-8% de los embarazos y constituye una causa importante de morbilidad y mortalidad en el mundo. En total, el 10-15% de las muertes maternas está directamente relacionado con la preeclampsia y la eclampsia. Algunos hallazgos epidemiológicos apoyan la hipótesis de una etiología genética e inmunológica. El riesgo de preeclampsia es 2-5 veces mayor en las embarazadas con antecedentes maternos de este trastorno. En función de la etnia, la incidencia de la preeclampsia oscila entre el 3% y el 7% en las nulíparas sanas y el 1% y el 3% en las multíparas. Por otra parte, se ha demostrado que la nuliparidad y una nueva pareja son factores de riesgo importantes. Otros factores de riesgo son el antecedente de hipertensión crónica, la enfermedad renal, la diabetes, la obesidad, haber nacido en África, edad ≥35 años y, las características del embarazo como el embarazo gemelar o molar, la preeclampsia previa o, las anomalías congénitas del feto. También se ha demostrado que la gran altura aumenta la incidencia de preeclampsia, atribuido a una mayor hipoxia de la placenta, al menor diámetro de la arteria uterina y al menor flujo de la arteria uterina inferior.
La preeclampsia puede poner en peligro la vida de la madre y del niño y aumenta la morbilidad y mortalidad maternofetal. Más adelante en la vida de la madre, puede causar enfermedad cardiovascular prematura, como hipertensión arterial crónica, isquemia cardíaca y accidentes cerebrovasculares, mientras que los niños nacidos después de la preeclampsia, embarazos no deseados o que son relativamente pequeños al nacer tienen mayor riesgo de accidente cerebrovascular, enfermedad coronaria y síndrome metabólico en la vida adulta. Siendo el parto el único tratamiento curativo, el manejo debe tener en cuenta continuamente el equilibrio riesgo-beneficio de la inducción del parto prematuro y las complicaciones maternofetales. En el manejo de la preeclampsia también es importante detectar a las mujeres con alto riesgo y prevenir las recurrencias.
Fisiopatología
Durante el embarazo normal, el citotrofoblasto velloso invade el tercio interno del miometrio mientras que las las arterias espiraladas pierden su endotelio y la mayor parte de sus fibras musculares. Estas modificaciones estructurales se asocian con alteraciones funcionales, de tal manera que las esas arterias se convierten en vasos de menor resistencia, y por lo tanto son menos sensibles, y aún más, se tornan insensibles a las sustancias vasoconstrictoras.
La preeclampsia tiene una fisiopatología compleja y es la causa principal de se placentación anormal. Durante la preeclampsia se observa la invasión defectuosa de las arterias espirales por las células del citotrofoblasto. Estudios recientes han demostrado que la invasión citotrofoblástica del útero es en realidad la vía de diferenciación única en la cual las células fetales adoptan ciertos atributos del endotelio materno que ellos normalmente reemplazan. En la preeclampsia, este proceso de diferenciación se desvía. Las anormalidades pueden estar relacionadas con la vía del óxido nítrico, lo que contribuye enormemente al control del tono vascular. Por otra parte, la inhibición de la síntesis materna de óxido nítrico evita la implantación del embrión. El aumento de la resistencia arterial uterina induce una mayor sensibilidad a la vasoconstricción y por lo tanto, a la isquemia crónica y el estrés oxidativo de la placenta. Esta isquemia placentaria crónica causa complicaciones fetales, incluyendo el retraso del crecimiento intrauterino y la muerte intraútero. Al mismo tiempo, el estrés oxidativo induce la liberación hacia la circulación materna de sustancias tales como los radicales libres, los lípidos oxidados, las citocinas y el factor de crecimiento endotelial vascular soluble en el suero. Estas anomalías son responsables de la disfunción endotelial vascular con hiperpermeabilidad, trombofilia e hipertensión, de manera que compensan la disminución del flujo en las arterias uterinas debido a la vasoconstricción periférica.
La disfunción endotelial es responsable de los signos clínicos observados en la madre, por ejemplo, el deterioro del endotelio hepático que contribuye a la aparición del síndrome HELLP (hemólisis, enzimas hepáticas elevadas y plaquetopenia); el deterioro del endotelio cerebral que induce la aparición de trastornos neurológicos refractarios o de eclampsia. El agotamiento del factor de crecimiento del endotelio vascular en los podocitos hace que la endoteliosis bloquee los diafragmas de hendidura de la membrana basal, provocando la disminución de la filtración glomerular y la proteinuria. Por último, la disfunción endotelial promueve la anemia hemolítica microangiopática y la hiperpermeabilidad vascular asociada a una hipoalbuminemia causante de edema, especialmente en las extremidades inferiores o en los pulmones.
Lo importante es comprender que el motor principal de la preeclampsia es la placentación anormal. Hay dos teorías comunes que parecen estar relacionados entre sí: la teoría de la enfermedad genética y la teoría inmunológica. Pueden existir varios genes de susceptibilidad genética para la preeclampsia. Estos genes probablemente interactúan con los sistemas hemostático y cardiovascular como así con la respuesta inflamatoria. Algunos han sido identificados, y en los estudios de genes candidatos se han hallado pruebas de vinculación con varios genes, incluyendo el angiotensinógeno en 1-P42-43 y eNOS en 7q36; otros loci importantes principales son 2p12, 2p25, 9p13 y 10q22.
La preeclampsia puede ser percibida como un deterioro del sistema inmune materno que impide reconocer la unidad fetoplacentaria. La producción excesiva de células inmunológicas provoca la secreción del factor de necrosis tumoral que induce la apoptosis del citotrofoblasto extravelloso. El sistema del antígeno leucocitario humano (HLA) también parece desempeñar un papel en la invasión defectuosa de las arterias espirales, ya que las mujeres con preeclampsia presentan niveles reducidos de HLA-G y HLA-E.18. Durante el embarazo normal, la interacción entre estas células y el trofoblasto se debe a la secreción del factor de crecimiento endotelial vascular y del factor de crecimiento placentario por las células asesinas naturales. En las mujeres con preeclampsia se han hallado niveles elevados de tirosinacinasa 1 símil fms soluble (sFlt-1), un antagonista del factor de crecimiento endotelial vascular y del factor crecimiento placentario.
En consecuencia, los niveles de sFlt-1, factor de crecimiento placentario, endoglina y factor de crecimiento endotelial vascular que aumentan 4-8 semanas antes de la aparición de la enfermedad, pueden ser útiles como predictores de preeclampsia. Datos recientes muestran el papel protector en el embarazo de la hemooxigenasa 1 y su metabolito de carbono, el monóxido de carbono, e identifican esto como un objetivo en el tratamiento de la preeclampsia.
Diagnóstico diferencial y resultados
Las pruebas clínicas y de laboratorio tienen por objeto definir y determinar la gravedad de la preeclampsia. Las cefaleas, los zumbidos de oídos, los fosfenos, los trastornos visuales, los reflejos tendinosos rápidos y los trastornos de la vigilancia están relacionados con el edema cerebral; la oliguria con la insuficiencia renal aguda; la contracción uterina y el sangrado vaginal con el desprendimiento de la placenta; los vómitos con el síndrome de HELLP; el dolor epigástrico en banda con el hematoma hepático subcapsular y la disnea con la insuficiencia cardiaca. La eclampsia, considerada la complicación neurológica principal de la preeclampsia, se define como un episodio convulsivo o cualquier otro signo de alteración de la conciencia que aparece en un entorno de preeclampsia y que no se puede atribuir a una enfermedad neurológica preexistente. El examen clínico debe incluir el registro de la presión arterial en reposo con un manguito adecuado, y la detección del aumento de peso, el edema (incluidos los signos de edema agudo de pulmón y convulsiones), la miocardiopatía y la insuficiencia renal aguda. El feto debe ser evaluado por electrocardiotocografía.
Laboratorio
Las pruebas incluyen: hemograma completo con recuento de plaquetas, haptoglobina, lactato deshidrogenasa, búsqueda de esquistocitos en el frotis de sangre, bilirrubina, aspartato aminotransferasa y alanina amino transaminasa con el fin de identificar el síndrome HELPP potencial; electrolitos, urea y creatinina parra detectar la insuficiencia renal aguda o la uremia, proteinuria de 24 horas, protrombina, tiempo de trombina activa y fibrinógeno (anemia hemolítica microangiopática), grupo sanguíneo y anticuerpos de detección irregular. Otros exámenes incluyen el ecoDoppler de las arterias del cordón umbilical, cerebral, y uterinas, la estimación del peso fetal, la evaluación del bienestar fetal por el puntaje de Manning, y el examen de la placenta.
Aunque la definición de preeclampsia grave varía, en general se aceptan varios componentes de esta definición: presión arterial sistólica materna ≥160 mm Hg o presión arterial diastólica ≥110 mm Hg; trastornos neurológicos de la madre como cefaleas persistentes, fosfenos, tinnitus y reflejos rápidos, difusos; reflejos tendinosos poliquinéticos, eclampsia, edema pulmonar agudo, proteinuria ≥5 g/día, oliguria < 500 cc/día, creatinina >120 mol/L, síndrome HELLP, trombocitopenia <100.000/mm3 y, criterios para el feto: especialmente retraso del crecimiento intrauterino, oligohidramnios o muerte fetal intrauterina. La preeclampsia leve se define por la presión arterial diastólica ≥ 90 mm Hg registrada en 2 ocasiones con por lo menos 6 horas de diferencia, combinada con proteinuria (2 o más apariciones de proteína con varilla; >300 mg de proteínas totales en orina de 24 horas o, una relación proteína:creatinina >30 mg/mmol).
Manejo de la emergencia inmediata
El parto es el único tratamiento curativo para la preeclampsia. El manejo es multidisciplinario, con un obstetra, un anestesista y un pediatra. En algunos casos puede ser necesaria la consulta de subespecialistas en medicina maternofetal y de hipertensión arterial o nefrología. Las decisiones del manejo deben equilibrar el riesgo materno de continuar el embarazo con los riesgos fetales asociados a la inducción del parto prematuro.
Los criterios para el parto se basan en dos factores a menudo relacionados entre sí, la edad de la gestación al momento del diagnóstico (se calcula el peso fetal) y la gravedad de la preeclampsia. La preeclampsia grave requiere el tratamiento con un doble objetivo, es decir, la prevención de los efectos nocivos de la elevación de la presión arterial de la madre y la prevención de la eclampsia. El manejo de la preeclampsia grave se inicia con el traslado de la madre en una ambulancia totalmente equipada o en un helicóptero a una sala de maternidad para proporcionar un nivel adecuado de atención, tanto para la madre como para el niño. Al ingreso y posteriormente, se pueden necesitar pruebas clínicas, cardiotocografía, análisis de laboratorio y ecografía, para establecer la gravedad de la preeclampsia y las medidas de manejo necesarias.
Independientemente de la gravedad de la preeclampsia, cuando se descubre después de las 36-37 semanas, la continuación del embarazo no ofrece ventajas. Tampoco se justifica el manejo expectante de la preeclampsia grave antes de la 24ª semana, en vista del alto riesgo de complicaciones maternas y el mal pronóstico neonatal. Luego, el equipo obstétrico debe discutir con los padres la posibilidad de una interrupción médica del embarazo. La prolongación del embarazo en el caso de preeclampsia leve puede ser discutida y reevaluada sobre una base regular. A los 34-37 semanas, el manejo depende de la gravedad de la preeclampsia. Para la preeclampsia leve es posible aplicar el manejo expectante, con el fin de limitar el riesgo del parto prematuro inducido, pero para la preeclampsia grave, el parto sigue siendo la norma debido al aumento al riesgo de mortalidad materna y las complicaciones fetales.
Del mismo modo, en las 24-34 semanas, el manejo depende de la gravedad de la preeclampsia. La presencia de uno o más de los siguientes signos indica la necesidad de un parto inmediato: hipertensión grave no controlada (no hay respuesta al tratamiento dual), eclampsia, edema pulmonar agudo, desprendimiento prematuro de la placenta, hematoma hepático subcapsular o, trombocitopenia <50,000/mm3. Si alguno de los siguientes criterios está presente: dolor epigástrico persistente, síntomas de eclampsia inminente (cefalea persistente o trastornos visuales) creatinina de novo >120 mol/L, oliguria <20 ml/hora, síndrome HELLP progresivo desaceleración variable o prolongada con poca variabilidad a corto plazo <3 milisegundos, es necesario el parto después del tratamiento con corticosteroides para la maduración pulmonar. Cuando no se requiere el parto de emergencia, puede ser inducido por maduración cervical.
El tratamiento antihipertensivo es útil solo en la preeclampsia grave, porque el único beneficio comprobado de dicho tratamiento es disminuir el riesgo de complicaciones maternas (hemorragia cerebral, eclampsia o edema pulmonar agudo). No hay consenso internacional sobre el tratamiento antihipertensivo en la preeclampsia. En Francia, los 4 fármacos autorizados para el tratamiento de la hipertensión grave en la preeclampsia son la nicardipina, el labetalol, la clonidina y la dihidralazina. No se han establecido valores objetivo de presión ideales, y una reducción demasiado agresiva de la presión arterial es perjudicial para el feto. Como tratamiento de primera línea se recomienda un solo agente, seguido del tratamiento combinado cuando es necesario.
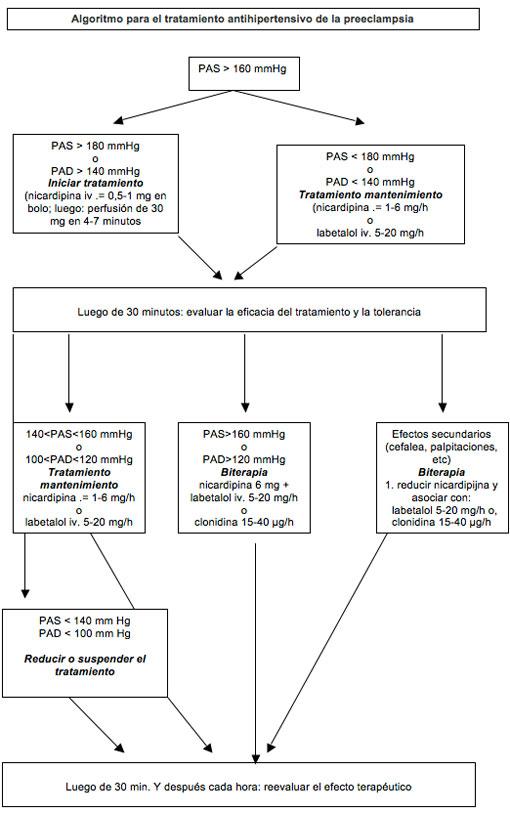
Se debe considerar la maduración pulmonar con corticoides, tomando en cuenta la edad gestacional. La betametasona sigue siendo el estándar de oro en una dosis de 2 inyecciones de 12 mg con 24 horas de diferencia; este tratamiento reduce el riesgo de la enfermedad de la membrana hialina, la hemorragia intraventricular y la mortalidad neonatal.
El sulfato de magnesio (SO4Mg) puede ser parte del arsenal terapéutico para la preeclampsia grave. Está indicado en el tratamiento de las convulsiones eclámpticas como así para la prevención secundaria de la eclampsia, por lo que sustituye al tratamiento cpm diazepam, fenitoína, o la combinación de clorpromazina, prometazina y petidina. La eficacia del SO4Mg para reducir la mortalidad materna y las complicaciones neonatales de la preeclampsia está bien establecida. Se administra por vía intravenosa, la primera vez en una dosis de carga de 4 g en 15-20 minutos, lo que se puede repetir con una dosis media (2 g) si se repite la convulsión, y luego una dosis de mantenimiento de 1 g/hora durante 24 horas. El tratamiento con SO4Mg debe ser seguido en la unidad de cuidados intensivos debido a que puede ocurrir una insuficiencia orgánica. Este monitoreo incluye la comprobación repetida del puntaje de Glasgow de 15, reflejos tendinosos, frecuencia respiratoria >12/minuto y una diuresis >30ml/hora. Cualquier manifestación de una sobredosis requiere detener la infusión, teniendo en cuenta la inyección de gluconato de calcio, y la medición de los niveles de magnesio en sangre.
La eclampsia se considera una indicación de cesárea de emergencia. Sin embargo, la decisión de retrasar la cesárea, aunque es rara, puede estar basada en el estado fetal y se justifica si la condición de la madre es estable y tranquilizadora después del tratamiento.
Manejo después del parto
Aunque el parto es el único tratamiento eficaz para la preeclampsia, y a pesar de que los síntomas clínicos y las anormalidades de laboratorio suelen disminuir después de las primeras horas, el riesgo de complicaciones persiste durante algún tiempo después del parto. La preeclampsia se asocia con morbilidad y mortalidad a largo plazo. Aproximadamente el 20% de las mujeres con preeclampsia desarrolla hipertensión o microalbuminuria durante el seguimiento a largo plazo, y el riesgo de enfermedad cardiovascular y cerebrovascular posterior se duplica en las mujeres con preeclampsia e hipertensión gestacional en comparación con los controles de la misma edad. Un estudio epidemiológico prospectivo reciente con una mediana de duración del seguimiento de 30 años brinda evidencia de que la preeclampsia es un marcador de mayor mortalidad por enfermedades cardiovasculares.
Para las pacientes con preeclampsia grave es necesario el monitoreo hemodinámico, neurológico y de laboratorio después del parto. El control hemodinámico incluye registros frecuentes de la presión arterial para permitir el ajuste del tratamiento antihipertensivo y el control frecuente de la diuresis y peso de acuerdo a la ingesta (la oliguria debe impulsar la reanimación con líquidos en forma progresiva y a veces el uso de diuréticos). El monitoreo neurológico consiste en el control de los signos de eclampsia inminente, incluyendo la cefalea, las señales de fosfeno, el tinnitus y los reflejos tendinosos rápidos. El monitoreo clínico debe hacerse varias veces al día durante la semana posterior al parto, un periodo considerado de alto riesgo de complicaciones. Si es necesario, el control se puede realizar en una unidad de cuidados intensivos.
El monitoreo de laboratorio debe hacerse varias veces al día durante las primeras 72 horas después del parto y, a partir de entonces, adaptado a la evolución de los índices. Debe incluir un hemograma completo, pruebas de función hepática y la determinación de la lactato deshidrogenasa. El alta hospitalaria no puede ser considerada hasta que todos los índices clínicos y de laboratorio se han normalizado siendo necesario el seguimiento de la hipertensión por el médico de cabecera después del alta.
Durante un embarazo posterior se debe considerar el riesgo de recurrencia de la preeclampsia. Se estima que este riesgo es <10% para todos los casos de preeclampsia, pero es mayor cuando la preeclampsia es descubierta antes de las 28 semanas. El riesgo relativo es 15 si la preeclampsia se produce en las semanas 20-33, 10 a las 33-36 semanas y, 8 después de la semana 37.
Tres meses después del parto, el médico de atención primaria de la paciente puede solicitar pruebas de detección de una enfermedad renal de base o de hipertensión. Esta selección tiene por objeto comprobar la normalización de las cifras de la presión arterial y la desaparición de la proteinuria, y si persisten las anomalías, el médico debe remitir a la paciente al nefrólogo o al especialistas en hipertensión, con el fin de determinar la causa. Este examen es importante debido a que la preeclampsia puede desenmascarar previamente una enfermedad sistémica o renal o una trombofilia no diagnosticadas. Se debe incluir un conjunto específico de preguntas, el registro de la presión arterial, un examen clínico en busca de signos de enfermedades autoinmunes y, una tira reactiva urinaria. Después de una preeclampsia grave se recomienda buscar anticuerpos antifosfolípidos. Ante una historia personal o familiar de enfermedad tromboembólica venosa, preeclampsia precoz o preeclampsia con cualquier retraso del crecimiento intrauterino, desprendimiento prematuro de la placenta o muerte fetal intrauterina se recomienda descartar la trombofilia hereditaria mediante el análisis de las proteína C y S, la antitrombina III y una prueba de resistencia a la proteína C activada. Si a los 3 meses después del parto persiste la insuficiencia renal o si se presentan signos de una enfermedad sistémica subyacente o la proteinuria persiste a los 6 meses, debe hacerse una biopsia renal percutánea con aguja.
Las pacientes que han tenido preeclampsia grave pueden tener tener la predisposición a compartir con los pacientes no embarazadas los factores de riesgo cardiovascular. En consecuencia, después de la preeclampsia grave se recomienda el monitoreo a largo plazo del riesgo cardiovascular, renal y metabólico.
Prevención
La prevención primaria de la preeclampsia se basa en la detección de los factores de riesgo modificables. En la literatura abundan los datos sobre los factores de riesgo de preeclampsia, pero deben ser interpretados con precaución. Las mujeres en alto riesgo son aquellos con antecedentes personales de preeclampsia grave, mientras que las de bajo riesgo se definen como aquellas que nunca han tenido preeclampsia pero que por lo menos tienen un factor de riesgo. Hay numerosos factores de riesgo, incluyendo los factores de riesgo genéticos, los antecedentes familiares de preeclampsia, los factores inmunológicos, la nuliparidad, una nueva pareja y, los factores demográficos como la edad materna >35 años, la edad gestacional propia de la mujer y el peso al nacer (con riesgos elevados para las mujeres nacidas antes de las 34 semanas o con un peso al nacer <2.500 g), los factores relacionados con el embarazo, tales como embarazo múltiple, anomalías congénitas o cromosómicas, mola hidatiforme o, infección urinaria, los factores de riesgo asociados a la enfermedad de la madre, como la hipertensión crónica, la enfermedad renal, la obesidad, la resistencia a la insulina y la diabetes, como la trombofilia y factores ambientales como vivir en una altitud elevada y el estrés. Aunque la búsqueda de estos factores de riesgo es importante, por sí mismos no pueden predecir efectivamente la preeclampsia.
Sin embargo, la predicción exacta de la preeclampsia permite un manejo óptimo de las mujeres de alto riesgo. En la actualidad se están evaluando varias pruebas de predicción que incluyen ensayos clínicos, como la medición de la presión arterial durante el segundo trimestre y el control ambulatorio de la presión arterial ambulatoria durante 24 horas, pero carecen de sensibilidad y especificidad.
Se han evaluado análisis de laboratorio para la respuesta oxidativa, como la determinación del ácido úrico, la calicreína urinaria y la fibronectina, pero hasta el momento no hay evidencia de su importancia. Entre los marcadores utilizados para la detección de la trisomía 21 durante el segundo trimestre (gonadotrofina coriónica ß humana, α-fetoproteína y estriol no conjugado), la elevación de la α-fetoproteína se asocia con mayor riesgo de preeclampsia (a menos que existan anomalías del tubo neural, como cuando la gonadotrofina coriónica ß humana es elevada). Puede ser útil el monitoreo frecuente de las mujeres con niveles elevados, pero estas pruebas no pueden llevarse a cabo para detectar los efectos debido a su bajo valor predictivo negativo. Se han probado los marcadores séricos de la trisomía 21 en el primer trimestre (proteína A plasmática asociada al embarazo, inhibina A, hormona liberadora de corticotrofina y activina), pero sus cocientes de probabilidad parecen ser insuficientes.
También se han evaluado los estudios por imagen, incluyendo el ecoDoppler de la arteria uterina, el cual no se recomienda durante el primer o segundo trimestre en poblaciones de bajo riesgo debido a la excesiva variabilidad de los cocientes de probabilidad en esta población, lo que permite la predicción de solo un tercio de los casos de preeclampsia. En una población de alto riesgo, la definición de cuál es, a menudo es imprecisa, el ecoDoppler de la arteria uterina se puede realizar durante el examen ecográfico morfológico del segundo trimestre y controlar un mes más tarde en el caso de resultados anormales (Índice de resistencia >0,58 o percentilo 90-95, muesca unilateral o bilateral). La combinación de un ecoDoppler de la arteria uterina durante el primer trimestre y una ecografía tridimensional que evalúe el volumen placentario puede predecir el riesgo de preeclampsia ya en el primer trimestre. Actualmente, ya que no hay un solo marcador eficaz para predecir el riesgo de preeclampsia, la tendencia en la práctica clínica es combinar los marcadores. La combinación más utilizada evalúa el sFlt-1, el factor de crecimiento de la placenta, la endoglina y el factor de crecimiento endotelial vascular durante el primer o segundo trimestre. El factor de crecimiento endotelial vascular y los niveles de endoglina aumentados, combinado con un aumento de sFlt-1 y la disminución del factor de crecimiento placentario durante el primer trimestre se asociam con un aumento significativo del riesgo de preeclampsia.
Cuando los marcadores séricos se combinan con los índices Doppler mejora la predicción de la preeclampsia. En un estudio de casos y controles anidados reciente se observó que la cistatina C sérica y la proteína C-reactiva de la madre, y el índice de resistencia media de la arteria uterina eran predictores independientes de preeclampsia. La prevención secundaria se basa en el efecto antiplaquetario de la aspirina, lo que reduce el riesgo de preeclampsia en un 10% de las mujeres que tienen al menos un factor de riesgo. Actualmente, ningún estudio permite determinar la dosis exacta o el mejor tiempo para el inicio de la aspirina. Sin embargo, la aspirina debe iniciarse tan pronto como sea posible, es decir, antes de las 12-14 semanas, lo que se corresponde con el inicio de la primera fase de la invasión trofoblástica. La eficacia de la aspirina solo aparece en las mujeres con antecedentes de preeclampsia asociada al retraso del crecimiento intrauterino y sin trombofilia. La heparina de bajo peso molecular se indica solo en los casos de trombofilia complicada (historia de complicaciones tromboembólicas o de preeclampsia).
También está recomendado el suplemento de calcio en una dosis de 1,5 g/día a partir de las 15 semanas y continuado durante todo el embarazo en mujeres con un consumo diario de 600 mg/día de calcio. Las estatinas, que estimulan la expresión de HO-1 e inhiben la liberación de sFlt-1 podrían tener el potencial de mejorar de inicio temprano de la preeclampsia. Otros tratamientos, tales como los antioxidantes, las vitaminas C y E, los oligoelementos y el ácido nítrico óxido no tienen una eficacia probada.
Conclusiones
La preeclampsia es una enfermedad rara relacionada con el embarazo, que tiene un curso impredecible con consecuencias graves tanto para la madre como para el feto. El tratamiento es sencillo, es decir, el parto. Sin embargo, la inducción del parto prematuro requiere una consideración cuidadosa de los riesgos y beneficios maternos y fetales. En consecuencia, la identificación de los criterios de parto en caso de preeclampsia es crucial para un manejo óptimo. La investigación actual se centra en la predicción del comienzo de la preeclampsia, incluso de la preeclampsia grave, a fin de que el tratamiento precoz mejore la morbilidad y la mortalidad asociadas con esta enfermedad. También deben desarrollarse herramientas específicas para la prevención secundaria, con el fin de evitar la recurrencia de la preeclampsia.
Dres. Jennifer Uzan. Marie Carbonnel, Olivier Piconne, Roland Asmar, Jean-Marc Ayoubi.
Vascular Health and Risk Management 2011:7 467–474

