Calcular la constante de la reacción de disociación del ácido yodhídrico en yodo molecular e hidrógeno molecular, si sabemos que en equilibrio tenemos 3.5X10-3 moles de ácido Yodhídrico y 4.8X10-4 moles de hidrógeno gaseoso. El volumen del contenedor es de 1 litro.

Análisis:
Se nos plantean tres objetivos, uno explícito y dos implícitos. El objetivo explícito es obtener la constante, el primer objetivo implícito obtener la masa del yodo molecular y el último objetivo implícito es escribir la expresión para la constante de equilibrio.
Objetivo 1. El yodo molecular
Las variables aparentan estar incompletas, pero si realizamos un análisis estequimétrico nos damos cuenta de que podemos obtener los moles de yodo molecular partir de las de hidrógeno molecular del siguiente modo.
1 mol de hidrógeno molecular se combina con 1 mol de yodo molecular, independientemente de la disociación y la constante las moles de ambos gases siempre son estequiométricamente iguales, es decir 4.8X10-4 moles.
Objetivo 2. Expresando la constante
Tenemos los datos del volumen y las moles, por lo que podemos usar el análogo de la concentración molar para los gases.
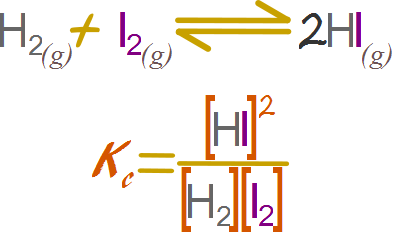
Objetivo 3. Calculando la constante
Obtenemos las concentraciones molares de todas las especies dividiendo entre el volumen, el cual al ser 1 no afecta la magnitud. Tenemos 4.8X10-4 molar de yodo gaseoso molecular e hidrógeno gaseoso molecular, y 3.5X10-3 molar de ácido yodhídrico.
Reemplazamos en la expresión y calculamos el resultado.
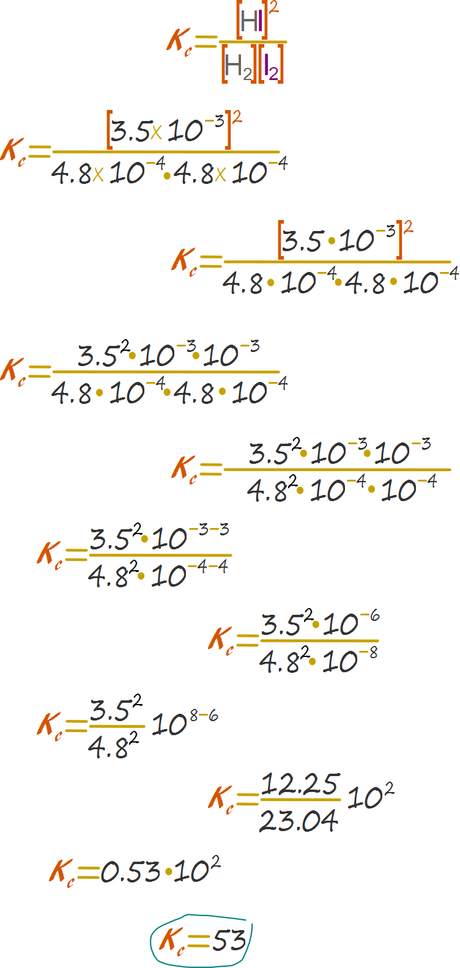 Sin embargo, el resultado anterior es la constante de la reacción de asociación, la disociación es la reacción inversa, por lo tanto la constante que buscamos se calcula dividiendo 1 entre el valor que hemos obtenido para la constante directa, en este caso el resultado verdadero es 0.0188.
PRINCIPAL
Sin embargo, el resultado anterior es la constante de la reacción de asociación, la disociación es la reacción inversa, por lo tanto la constante que buscamos se calcula dividiendo 1 entre el valor que hemos obtenido para la constante directa, en este caso el resultado verdadero es 0.0188.
PRINCIPAL
REGRESAR
