El ejemplo 4 noes mostró como no se debe afrontar un ejercicio de equilibrio, ahora veremos un ejercicio completo usando el método analítico
En la síntesis de ácido yodhídrico a partir de yodo gaseoso molecular e hidrógeno gaseoso molecular.

Suponga que tiene un reactor con 1 mol de hidrogeno molecular gaseoso y 2 mol de yodo molecular gaseoso. El volumen del reactor es de 1L. Determinar las concentraciones de las especies de la mezcla de reacción en el estado de equilibrio cuando la reacción ocurre a 458°C? La constante de equilibrio para la temperatura determinada es de 49,7
El plan: Determinar la concentración de la especies al inicio de la reacción Determinar los valores de cambio Determinar las expresiones algebraicas que representan la concentración de la especies en el estado de equilibrio Escribir la expresión para la constante de equilibrio Resolver el problema algebraico Reemplazar en la cuadrática y calcular el valor de x
Resolvemos: Determinar la concentración de la especies al inicio de la reacción
Al inicio de la reacción tenemos que (al ser el volumen de 1L) la concentración es de 1 molar de hidrogeno molecular gaseoso y 2 molar de yodo molecular gaseoso. El producto es de 0 molar al inicio.
Determinar los valores de cambio Esto se realiza mediante la tabla de cambios
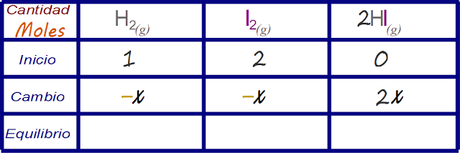
Determinar las expresiones algebraicas que representan la concentración de la especies en el estado de equilibrio
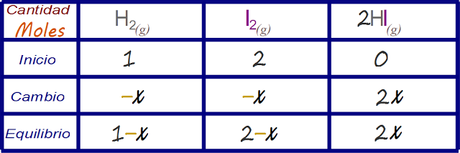
Escribir la expresión para la constante de equilibrio
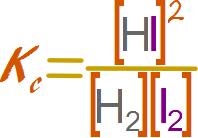
Resolver el problema algebraico Dado que emplearemos un método analítico, emplazaremos el valor de 1 por z y el valor de 2 por m.
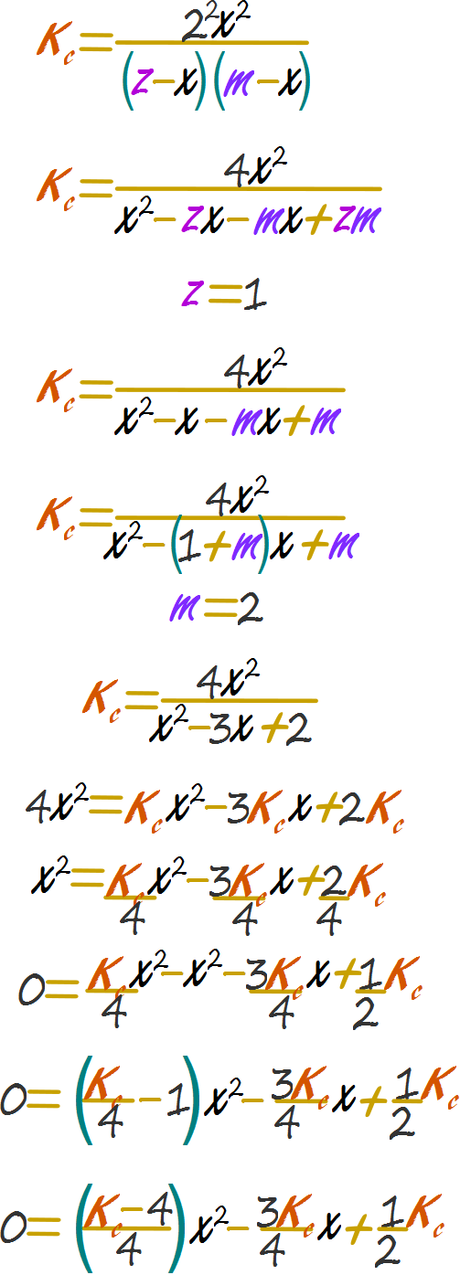
Reemplazar en la cuadrática y calcular el valor de x
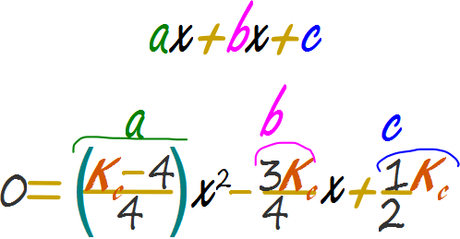
Dado que las expresiones no son de fácil manejo algebraico reemplazaremos inmediatamente en la siguiente tabla de Excel.
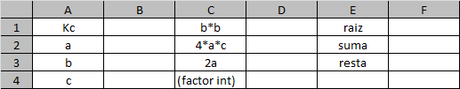
Y emplearemos las siguientes fórmulas
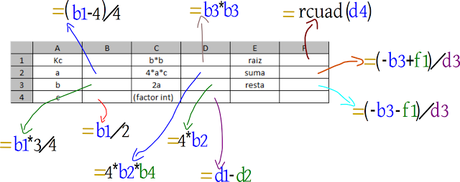
Todo queda en términos de la constante.
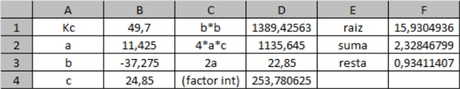
Por lo anterior nos quedan dos valores de x: x1 =2.33; x2= 0.93.
Sin embargo 2.33 da un valor negativo en la resta 1-x por lo cual el resultado que da un valor con sentido químico es x2.
De este modo el resultado es:
Yodo molecular gaseoso = 1.07 molar → (1L) → 1.07 mol Hidrógeno molecular gaseoso = 0.07 molar → (1L) → 0.07 mol
Acido yodhídrico gaseoso = 1.86 molar → (1L) → 1.86 mol PRINCIPAL
REGRESAR
