Apoptosis, la mitocondria y el suicidio celular Muerte celular programada Definición del término apoptosis Ruta extrínseca de la apoptosis Ruta intrínseca de la apoptosis Ruta extrínseca de la apoptosis
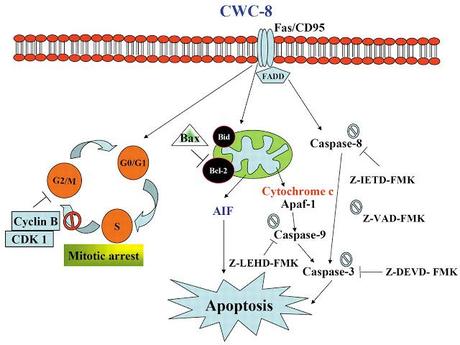
En este caso el estímulo apoptótico es transportado por un mensajero extracelular llamado factor de necrosis tumoral (TNF) el cual es célebre por su habilidad para inducir a las células de tumores cancerígenos a suicidarse en masa.
El factor de necrosis tumoral es producido por ciertas células del sistema inmune en respuesta a diversas condiciones como la exposición a radiación ionizante, la elevación de la temperatura, infecciones virales, agentes químicos tóxicos tales como los que se emplean en la quimioterapia contra el cáncer.
Todo mensajero en los seres vivos requiere de una proteína integral de la membrana que funge como su receptor especifico, en este caso existe no una, sino toda una familia de proteínas llamada “receptores de muerte” llamada formalmente TNFR.

Video REA-01. El presente video representa ambas rutas, la extrinseca va desde 00:00 hasta 02:41. La ruta se activa por una célula del sistema inmune que tiene insertada en su membrana la proteína mensajera TNF, la cual se une a TNFR en 01:14, posterior a esto se reclutan FADD en 01:28 y luego se activa la pro-caspasa en 01:42; caspasa-8 activa la procaspasa-3 en 1:58 generando la cascada de activación.
La evidencia indica que los receptores de muerte TNFR están presentes en la membrana como un trímero pre-ensamblado. El dominio citoplasmático de cada subunidad de TNFR contiene un segmento de unos 70 aminoácidos llamados “dominio de muerte” que median en las interacciones entre proteínas.Cuando el mensajero TNF se une al receptor TNFR se produce un cambio conformacional en los dominios de muerte en el citoplasma celular, el cual conlleva al reclutamiento de cierto tipo de proteínas llamadas FADD.
Estas proteínas llamadas FADD reclutan una segunda serie de proteínas pro-caspasas debido a que son precursores inactivos de la caspasa. La caspasa funciona de manera muy similar a los factores de coagulación al ser una proteasa que se encuentra inactiva normalmente, y que para activarse debe ser cortada debido a la presencia de un segmento inhibidor en su región activa, pero se diferencia de las proteasas de serina en que a demás de un corte debe fucionarse con otra procaspasa. En resumen, el receptor con las FADD que son como dedos separa una parte de cada pro-caspasa y luego une lo que ceda para formar la caspasa-8.
Sin embargo, a diferencia de la gran mayoría de las pro-enzimas líticas, las pro-caspasas exhiben ciertos niveles proteolíticos remanentes. De hecho en ocasiones esta actividad remanente puede causar que dos caspasas puedan activarse una a otra generando reacciones en cadena no controladas.
En cualquier caso, la enzima final madura llamada caspasa-8 contiene cuatro cadenas de polipéptidos, derivadas de dos precursores pro-caspasa. La activación de la caspasa-8 es similar a la activación de los efectores mediante la hormona de factor de crecimiento.
La caspasa-8 como se ha mencionado antes es una proteína lítica pero que activa a la procaspasa-3, el resultado es la caspasa-3 que corta en una diversa cantidad de proteínas celulares, pero que también causa la activación de otras pro-caspasas lo que la convierte en el “ejecutor de muerte” de la apoptosis. PRINCIPAL REGRESAR
