Una preocupación central de la química en el siglo XVIII era el proceso de combustión. Cuando las sustancias se calentaban hasta el punto de incandescencia, los científicos vieron que emitían algo -vapores o humo-, y lo interpretaron como una pérdida de la sustancia original. Ese " algo", que supuestamente, se perdía en el proceso de combustión se llamó flogisto , una palabra acuñada en 1697 por el químico alemán Ernst Stahl. Pero qué era exactamente ese flogisto seguía siendo materia de debate. Para algunos, era un elemento en sí mismo; para otros, era una esencia contenida en los materiales combustibles, sin la cual la combustión era imposible.

Georg Ernst Stahl (1660-1734), siguiendo a su maestro Becher (1635-1682), creyó que las sustancias estaban formadas por tres tipos de tierra: "tierra", "agua" y "aire". A una de las tres tierras, aquella que Becher había llamado "combustible", la rebautizó como flogisto (del griego, que significa " quemado" o " llama"), al que le asignó el noble y supremo propósito de ser el agente y el sostén de la combustión. La combustión, según Stahl, consistía en un i ntercambio de flogisto, que fluía entre los materiales con la soltura (aunque con más calor) del éter; quemarse era dejar escapar flogisto (que como un humo invisible se mezclaba con el aire), y lo que un químico moderno llamaría reducción consistía en incorporar el flogisto flotante como para tenerlo listo para una nueva combustión.
El concepto del flogisto dio lugar a algunas anomalías. Si fuera un componente de los materiales combustibles, al perderse durante la combustión, los residuos tenían que pesar menos de lo que pesaban las sustancias antes de quemarse, y ése era el caso de algunas, como la madera. Pero ciertos metales, cuando se calentaban, se convertían en una sustancia blanda llamada calx; en estos casos, el residuo pesaba más que el metal original. Esta anomalía fue ignorada por muchos defensores de la teoría del flogisto. Otros la racionalizaban sugiriendo que el flogisto tenía un peso negativo, provocando que el residuo pesase más cuando el flogisto se había consumido.
De acuerdo con las ideas de Stahl, los metales estaban formados por flogisto y la cal correspondiente, de modo que, cuando se calcinaban, el flogisto se desprendía y dejaba libre la cal. Del mismo modo, para obtener el metal a partir de la cal, era necesario añadirle flogisto, el cual podía obtenerse a partir de una sustancia rica en este principio, como el carbón.
Lavoisier experimentaba con fósforo y azufre, sustancias que se ardían fácilmente. Demostró que, al combinarse con el aire, aumentaban de peso. Con carbonato plomo podía capturar una gran cantidad de aire, que se liberaba cuando se calentaba dicha sustenacia. Para Lavoisier, que a estas alturas ya era escéptico, el flogisto no podía explicar estos resultados.
Lavoisier se dio cuenta de que la combustión involucraba al aire, la composición exacta del aire no se conocía por aquel entonces. En agosto de 1774, el eminente filósofo natural inglés Joseph Priestley se reunió con Lavoisier en París. Describió cómo, recientemente, había calentado cal de mercurio (un polvo rojo, óxido de mercurio) y recogido un gas que hacía arder una vela de manera potente. Priestley creía que su "aire puro" mejoraba la respiración y hacía que las velas ardiesen por más tiempo porque estaba libre de flogisto. Por esta razón, llamó al gas que obtuvo de la descomposición de la cal de mercurio "aire desflogisticado".
Intrigado, Lavoisier repitió en París el experimento de Priestley con mercurio y otros metales. Finalmente llegó a la conclusión de que el aire común no era una sustancia simple. En cambio, argumentó, debía de haber dos componentes: uno que se combinaba con el metal y apoyaba la respiración, y otro que no apoyaba ni la combustión ni la respiración. En 1777, Lavoisier estaba listo para proponer una nueva teoría de la combustión que excluía el flogisto. La combustión, dijo, era la reacción de un metal o una sustancia orgánica con esa parte del aire común que denominó "eminentemente respirable". Dos años después, anunció a la Real Academia de Ciencias de París que había descubierto que la mayoría de los ácidos contenían este aire respirable. Lavoisier lo llamó oxígeno, combinando las dos palabras griegas para decir generador de ácido.
Lavoisier comenzó su ataque a gran escala contra el flogisto en 1783, afirmando que "el flogisto de Stahl es imaginario". Llamó al flogisto "un verdadero Proteo, que cambia de forma a cada instante", Lavoisier afirmó que era hora de " reconducir la química a una forma más estricta de pensar" y " distinguir lo que es hecho y observación de lo que es sistema e hipótesis". Como punto de partida, ofreció su teoría de la combustión, en la que el oxígeno juega un papel central.
Mirando retrospectivamente, cuando la mayoría de las personas educadas hoy día comprende el papel del oxígeno en la combustión y todos los estudiantes de química saben que la combustión es un proceso de cambio químico, cuyo resultado no produce pérdidas o ganancias significativas de masa, es fácil sentirse superior a aquellos tempranos buscadores de la verdad. Pero eran personas capaces, y sus razonamientos tenían sentido bajo la luz del limitado conocimiento que poseían.
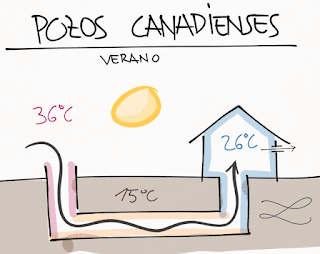
La climatización de los hogares lleva asociado un importante gasto económico. Existen métodos de climatización casi gratuitos y apenas utilizados, como los pozos canadienses. Los pozos canadienses, también conocidos como provenzales (por su uso en la región Francesa de Provenza), son sencillos sistemas de climatización geotérmica. Los pozos canadienses están formados por redes de tuberías ubicadas en el subsuelo exterior de las viviendas, conectados a ellas y que trabajan bajo el principio de la inercia térmica para ajustar la temperatura del aire que se emplea en la vivienda. Este sistema no consume energía eléctrica, por lo que tras su instalación, la climatización de nuestra casa será más económica. Tecnología natural de bajo coste , ecológica , eficiente y sostenible . Pozo canadiense en verano. El pozo canadiense o pozo provenzal es una técnica de climatización que permite mantener más fresca la casa en verano , y más cálida en el invierno. Si comenzamos a tomar temperaturas de
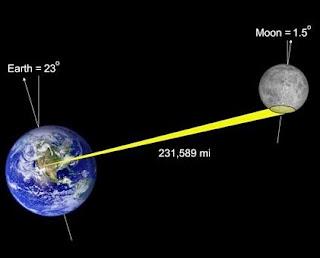
En la antigüedad se creía que la luna se encontaba a unos 32 km de la Tierra. En Grecia, Hiparco de Nicea (190-120 a.C.) dedujo que la Luna est aba a una distancia de 384.000 km de la Tierra. Hay que tener en cuenta que la orbita lunar no es circular, sino elíptica. Desde la segunda mitad del siglo XX, se aceptan las siguientes cifras como válidas: Distancia cuando la Luna está más cerca de la Tierra: 356.334 km . Distancia cuando la Luna está más lejos de la Tierra: 406.610 km . Desde hace cerca de 40 años, la medición de la distancia Tierra-Luna se realiza a diario. Un pulso de rayo láser es lanzado desde un observatorio de Texas. Este rayo cruza la distancia Tierra-Luna, e impacta en un panel de espejos reflectores colocados en la Luna. Los espejos reflectores envían el pulso de vuelta en la misma dirección desde la que llegó. De vuelta a la Tierra, el telescopio intercepta el pulso de retorno. Esto permite medir con elevada precisió

Es probable que la ley de Fick y el fenómeno físico que describe, sean unos de los conceptos científicos menos conocidos por el gran público. La experiencia nos demuestra que cuando abrimos un frasco de perfume o de cualquier otro líquido volátil, podemos olerlo rápidamente en un recinto cerrado. Decimos que las moléculas del líquido después de evaporarse se difunden por el aire, distribuyéndose en todo el espacio circundante. Lo mismo ocurre si colocamos un terrón de azúcar en un vaso de agua, las moléculas de sacarosa se difunden por todo el agua. Estos y otros ejemplos nos muestran que para que tenga lugar el fenómeno de la difusión, la distribución espacial de moléculas no debe ser homogénea, debe existir una diferencia, o gradiente de concentración entre dos puntos del medio. Si tenemos en un punto una concentración C1 de sustancia y en otro lugar próximo otra concentración C2, se observa que si: C1 > C2, la materia se mueve d
