La literatura ya inventó hace mucho el corazón que late por su cuenta -con El corazón delator de Edgard Allan Poe-, pero la ciencia no había estado a la altura hasta hoy. Un equipo de la Universidad de California en Berkeley ha utilizado una combinación de métodos bioquímicos (genes, moléculas) y biofísicos (formas, tensiones mecánicas) para convertir las células madre derivadas de un paciente en un minicorazón que, esencialmente, se autoensambla, forma sus cámaras y empieza a latir espontánea y coordinadamente.
El corazón es muy similar al que se forma en el feto. Como las células madre de partida están derivadas de la piel de pacientes (son células iPS, o células madre de pluripotencia inducida), el corazón es genéticamente idéntico al paciente en cuestión. Kevin Healy, Bruce Conklin y sus colegas de Berkeley esperan que el miniórgano sirva para estudiar las fases tempranas del desarrollo del corazón, tanto en condiciones normales como patológicas. Y sobre todo para probar baterías enteras de fármacos y evaluar sus efectos sobre el desarrollo cardiaco: una buena forma de saber qué medicamentos puede tomar una embarazada.
Como uno de los principales objetivos de estos miniórganos es probar el efecto de los fármacos sobre el desarrollo cardiaco.
Desde las primeras décadas del siglo XX, con el rápido desarrollo de la genética en el laboratorio de Thomas Morgan en Nueva York, el paradigma del desarrollo embrionario se ha basado en los genes, que se activan o reprimen en según qué células del embrión, y en el intercambio de señales químicas entre células vecinas. Pero ya en 1917, el gran biólogo y matemático escocés D'Arcy Thompson advirtió a sus colegas que estaban descuidando otro ángulo de la cuestión: las fuerzas mecánicas o, más en general, las leyes de la física.
Los científicos de Berkeley, que reconocen el precedente de D'Arcy Thompson en la primera línea de su artículo -publicado en Nature Communications-, no solo han utilizado señales químicas para estimular a las células madre a diferenciarse como tejido cardiaco, sino que también les han impuesto guías y restricciones mecánicas, como barreras circulares que no pueden sobrepasar, y que les imponen ciertas geometrías y tensiones que emulan a las del desarrollo del embrión.
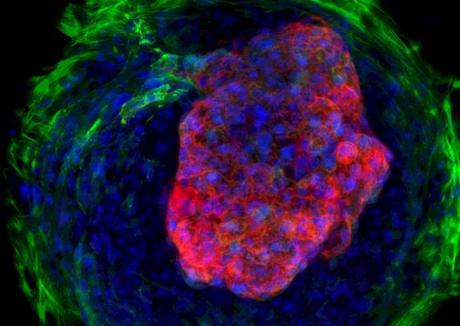
En el plazo de un par de semanas, las células se autoorganizan según su posición en el círculo al que han sido restringidas. Las células de la periferia experimentan mayor tensión mecánica, y como consecuencia empiezan a diferenciarse como fibroblastos, las células que forman el tejido conectivo y producen colágeno. Las células del centro, que experimentan poca tensión mecánica, se diferencian como cardiomiocitos, o células del músculo cardiaco.
Como las células madre de partida están derivadas de la piel de pacientes (son células iPS, o células madre de pluripotencia inducida), el corazón es genéticamente idéntico al paciente en cuestión.
A partir de esta organización temprana del trabajo, lo que empezó como una simple superficie empieza a autoorganizarse en 3D, formando las cámaras cardiacas en una emulación del proceso de desarrollo normal. "El patrón geométrico confinado provee las pistas bioquímicas y biofísicas que dirigen la diferenciación cardiaca y la formación de microcámaras que laten", explica el primer autor del trabajo, Zhen Ma, de la Universidad de California en Berkeley.
Como uno de los principales objetivos de estos miniórganos es probar el efecto de los fármacos sobre el desarrollo cardiaco, los autores han expuesto sus minicorazones en proceso de diferenciación a una droga de conocidos (y gravísimos) efectos perjudiciales: la talidomida. Este fármaco, en efecto, utilizado en las dosis terapéuticas típicas sobre los miniórganos, causa un desarrollo anormal de las microcámaras, una contracción muscular deficiente y un ritmo de latido más lento de lo normal. La idea ahora es hacer lo mismo con todo fármaco sospechoso.
"Aquí nos hemos centrado en el desarrollo cardiaco temprano", explica Healy, "pero los principios básicos para distribuir geométricamente las células madre humanas y después diferenciarlas se puede extender fácilmente a un amplio rango de tejidos para entender la embriogénesis y la morfogénesis (la generación de formas)". Los investigadores predicen que este tipo de sistemas acabará sustituyendo a los modelos animales para muchos propósitos.
D'Arcy se estará agitando satisfecho en su tumba.
C. Marco

