 El actinio se puede encontrar de forma solida en la naturaleza, presenta un aspecto visual de color plateado. El número atómico es 89 y su símbolo químico es el Ac. El punto de fusión del actinio es de 1 grados Kelvin o de -271,15 grados celsius o grados centígrados, su punto de ebullición es de 3 grados Kelvin o de -269,15 grados celsius o grados centígrados.
El actinio se puede encontrar de forma solida en la naturaleza, presenta un aspecto visual de color plateado. El número atómico es 89 y su símbolo químico es el Ac. El punto de fusión del actinio es de 1 grados Kelvin o de -271,15 grados celsius o grados centígrados, su punto de ebullición es de 3 grados Kelvin o de -269,15 grados celsius o grados centígrados.
Símbolo: Ac
Número atómico: 89
Grupo: 3
¿Qué es el actinio?
El actinio es un elemento químico que forma parte del grupo de los actínidos. Estos conforman a los elementos que poseen un mayor número atómico, a su vez no se les puede encontrar en la naturaleza y su tiempo de vida es bastante corto. Todos los isótopos del grupo de los actínidos, entre los que se encuentra el actinio, son totalmente radiactivos.
 Características del actinio
Características del actinioUna de las características más resaltantes de actinio, es el hecho de ser un metal radioactivo, como lo son todos los actínidos, aunque este presenta un color plata. Debido a la alta radiactividad que posee brilla en la oscuridad con una luz azulada.
El isótopo 227Ac, que solo se puede encontrar en trazas dentro de los minerales de uranio, es un emisor directo de partículas α y β con un periodo de semidesintegración de 21,773 años por partícula. Sus trazas son tan bajas dentro de las que una tonelada de mineral de uranio contiene tan solo un gramo de actinio.
El comportamiento de este elemento químico es muy parecido al del resto de las tierras raras por sobre todo al del lantano, elemento que se encuentra justo encima de él dentro la tabla periódica.
Cuál es su historia y quién lo descubrió
El actinio fue famosamente descubierto por un químico de origen francés, llamado André-Louis Debierne, a finales del siglo XIX, luego de poder obtener el elemento a través de la pechblenda. En sus inicios este químico lo percibió como un elemento sumamente similar al titanio, y posteriormente se cambió esta percepción al torio en 1900.
Para el año 1902 fue descubierto, de forma directa por Friedrich Oscar Giesel el cual lo percibió como sus un elemento muy similar al lantano y le dio al mismo el nombre de emanium en el año 1904.
Luego de haber realizado las comparaciones entre estas sustancias anteriormente comparadas a finales de 1904 se estableció que eran idénticas y el nombre propuesto por Debierne fue retenido gracias a que tenía prioridad.
Se acabó comparando con otros tres elementos que habían sido descubiertos entre 1898 y 1900: el polonio y el radio por los químicos Marie y Pierre Curie y el radón, un gas el cual se desprende durante la desintegración radiactiva de algunos elementos más pesados descubierto el químico alemán Friedrich Ernst Dorn para el año 1900, dando como resultado ciertas similitudes gracias a sus comparables por su radioactividades.
Propiedades del actinio
Las propiedades químicas del actinio son:
Símbolo químico: Ac
Número atómico: 89
Grupo: 3
Periodo: 7
Bloque: f
Densidad: 10.070 kg/m3
Masa atómica: 2.7 u
Radio medio: 195 pm
Configuración electrónica: rn 6d 17s2
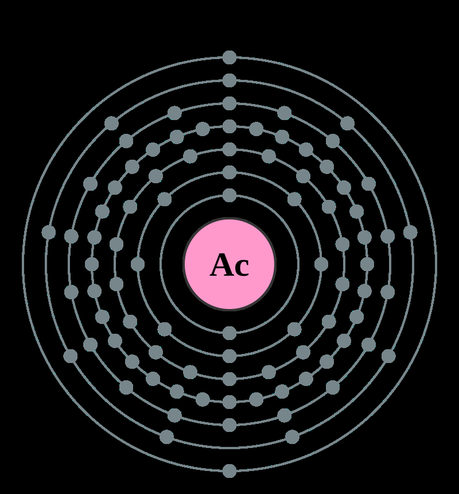
Electrones por capa: 2, 8, 18, 32, 18, 9, 2
Estados de oxidación: 3
Estructura cristalina: cúbica
Estado: sólido
Conductividad térmica: 12 W/(K·m)
Electronegatividad: 1,1
Punto de ebullición: 3 K
Punto de fusión: 1 K
Calor de fusión: 62 kJ/mol
Aspecto: plateado
 Para qué sirve
Para qué sirveEl actinio no es un elemento químico que se pueda comprar en cualquier farmacia, debió a su radioactividad su uso esta reducido solo a organizaciones científicas. La radiactividad del actinio supera 150 veces más a la del radio, convirtiéndose en una excelente fuente de neutrones; pero a pesar de esto, no tiene aplicaciones industriales significativas por sus limitaciones comerciales.
Gracias al mismo se puede obtener el francio, elemento numero 87 de la tabla periódica, el cual es un metal alcalino radiactivo descubierto para 1939, la cual se obtiene en cantidades muy mínimas como resultado de un proceso de decaimiento específico del del isotopo 227Ac en la serie radiactiva que tiene inicio con el 235U.
Dentro de la medicina el isotopo 225Ac se emplea dentro de la producción de Bi-213 utilizado en radioterapia para tratar el cáncer. Para lograr esto se combina al isotopo 225Ac con el anticuerpo monoclonal lintuzumab el cual forma un radioinmunoconjugado emisor de radiación alfa el cual se abrevia como 225Ac-HuM195 y cuenta con una posible actividad antineoplásica.
Dónde se encuentra el actinio
El actinio no se encuentra fácilmente, este debe ser extraído de una corta lista de elementos, estos son: AcF3, AcCl3, AcBr3, AcOF, AcOCl, AcOBr, Ac2S3, Ac2O3 y AcPO4. Todos los elementos anteriormente listados, contienen una estructura extremadamente similar a los que corresponden al lantano, por lo cual se contempla en todos ellos que el actinio cuenta con una capacidad de oxidación de +3.
Se encuentran pequeñas y raras trazas de actinio 227Ac en minerales de uranio, pero comúnmente se solo se logran obtener cantidades expresadas en miligramos, para extraerlo se bombardea 226Ra con neutrones contenidos adentro de un reactor nuclear, el cual es seguido por una desintegración de β- del isotopo 227Ra resultante.
 La obtención del actinio se puede lograr gracias a la reducción del fluoruro de actinio con vapor de calcio, litio o magnesio a una temperatura de entre 1100 y 1300 °C. Otra forma sería a través de la desintegración de 235U o de la uranitita (U3O8). Debemos destacar que el actinio logro producirse de manera artificial por primera vez en el Argonne National Laboratory de Chicago.
La obtención del actinio se puede lograr gracias a la reducción del fluoruro de actinio con vapor de calcio, litio o magnesio a una temperatura de entre 1100 y 1300 °C. Otra forma sería a través de la desintegración de 235U o de la uranitita (U3O8). Debemos destacar que el actinio logro producirse de manera artificial por primera vez en el Argonne National Laboratory de Chicago.Importancia
El actinio 227, como se le es conocido, debido a que es un elemento extremadamente radioactivo, con obvios efectos negativos por causas de radiación altamente nocivos para la salud, incluso comparable en peligro al plutonio, se encuentra extremadamente limitado su uso. Tan solo la ingesta de 1 miligramo de este metal podría causar cáncer al individuo en menos de 48 horas.
Su uso más amplio se ha visto en los desarrollos de la tecnología nuclear en donde ha acompañado a la misma a través de pequeñas liberaciones de radioactividad a la atmósfera, los suelos, los océanos, mares, y nivel acuífero, apareciendo por todo el mundo en la materia animal, vegetal e inerte. La radiación pasa de una especie a otra y se concentra a través de la cadena alimenticia, logrando que otros animales y humanos estén sujetos a sus efectos dañinos.

