 La estructura de proteínas y la cristalografía han ido siempre de la mano. Uno de los mayores cuellos de botella para resolver una estructura era obtener buenos cristales que difractasen aportando mapas de suficiente resolución. Sin embargo, los avances en la microscopía junto con la evolución de la computación han dado a la luz una nueva técnica para resolver la estructura de proteínas que ya no requiere de la formación de cristales, se trata de la criomicroscopía.
La estructura de proteínas y la cristalografía han ido siempre de la mano. Uno de los mayores cuellos de botella para resolver una estructura era obtener buenos cristales que difractasen aportando mapas de suficiente resolución. Sin embargo, los avances en la microscopía junto con la evolución de la computación han dado a la luz una nueva técnica para resolver la estructura de proteínas que ya no requiere de la formación de cristales, se trata de la criomicroscopía.Que la criomicroscopía ha supuesto un paso importante para la estructura de proteínas se puede ejemplificar con una de las proteínas estrella del laboratorio de Estructura y Función de Enzimas capitaneado por Julio Polaina, la beta galactosidasa, TmLac.
Todo se remonta al año 2011-2012 cuando empecé mi doctorado tomando esa proteína como modelo y nos propusimos, junto con Julia Sanz Aparicio y su grupo, desvelar la estructura y hacer así nuevas variantes de la proteína mediante diseño racional. Sin embargo, no ha podido ser hasta 7 años después, con la tesis ya leída, en que hemos podido publicar un artículo con la estructura de la proteína. ¿La razón? Durante todo este tiempo no ha sido posible cristalizar la proteína para que difracte a una resolución suficiente. Ha sido la criomicroscopía la que ha terminado por resolver la estructura. La preparación de las muestras de proteína, a diferencia de la cristalización, no requiere del uso de altas concentraciones para la formación de cristales, facilitando así la resolución estructural de proteínas que no se puedan producir en grandes cantidades. Las muestras son teñidas y tratadas con óxido de grafeno y posteriormente observadas al microscopio. Y aquí es donde todo lo sabido y por saber acerca de los microscopios requiere ser actualizado y puesto a punto. Rafa F. Leiro, que trabajó durante parte de su postdoc con Julia Sanz Aparicio y que también estuvo durante 5 años en el MRC Laboratory of Molecular Biology en Cambridge, ha sido quien ha aportado al estudio esta nueva tecnología. Actualmente es investigador junior en el Centro Nacional de Investigaciones Oncológicas (CNIO).El microscopio utilizado todavía no está disponible en España, se trata de un microscopio FEI Titan Krios, del que he puesto un pequeño vídeo para que veáis que nada tiene que ver con un microscopio electrónico al que estáis acostumbrados.
En el caso de la TmLac han hecho falta un total de 2873 microfotografías seleccionadas entre un total de 3123. El procesamiento y refinamiento de las fotografías de las distintas partículas ha permitido obtener una resolución de 2 amstrongs y esclarecer la estructura en aquellas zonas donde la estructura por cristalografía de rayos X no lograba suficiente resolución.

| Representative negative-stain 2D classes of the different TmLac WT and hybrids. Top views, side views, and broken top views are shown. Black arrows indicate the inner channel of the octamer.* |
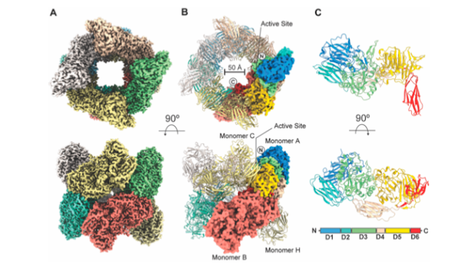
Estructura general de la TmLac
Por otro lado, se ha podido realizar un estudio acerca de la posición que adoptan dominios de unión a carbohidratos para la inmovilización de la TmLac a soportes de celulosa y de quitina, facilitando la selección del híbrido más adecuado para la obtención de un buen rendimiento durante el proceso de inmovilización. Una de las dudas que teníamos era la disposición de esos dominios en la estructura cuaternaria y si influían o no en el proceso de oligomerización. De nuevo, la criomicroscopía ha permitido ver la posición que adoptan los CBMs (CBM2 y CBM9) cuando son colocados en posición N-terminal y C-terminal, así como su interacción con el resto de la estructura.Pero, sobre todo, lo más importante del artículo es que aparte de aportar detalles muy relevantes para la futura mejora por ingeniería genética de la proteína y su aplicación en uso industrial, es el golpe sobre la mesa que ha dado esta técnica, consiguiendo resolver la estructura de una proteína que estaba dando muchísima guerra en su cristalización.En muchas ocasiones los investigadores solemos dar mucha importancia a los artículos en los cuales somos primer autor, sin embargo en este caso este artículo ha sido para mí uno de los que más orgulloso estoy en haber participado por desvelar la estructura de la proteína que fue la semilla de mi tesis doctoral y por formar parte de uno de los artículos que muestra una técnica que sin duda será un punto de inflexión en el campo de la estructura y función de enzimas.Os dejo la referencia del artículo y aprovecho para desearos un fructífero año 2020.

Míguez Amil, S., Jiménez-Ortega, E., Ramírez-Escudero, M., Talens-Perales, D., Marín-Navarro, J., & Polaina, J. et al. (2019). The cryo-EM Structure of Thermotoga maritima β-Galactosidase: Quaternary Structure Guides Protein Engineering. ACS Chemical Biology. doi: 10.1021/acschembio.9b00752
*"Reprinted with permission from Míguez Amil, S., Jiménez-Ortega, E., Ramírez-Escudero, M., Talens-Perales, D., Marín-Navarro, J., & Polaina, J. et al. (2019). The cryo-EM Structure of Thermotoga maritima β-Galactosidase: Quaternary Structure Guides Protein Engineering. ACS Chemical Biology. doi: 10.1021/acschembio.9b00752. Copyright 2019 American Chemical Society."

