 Cada segundo que respiramos, dormimos, comemos y hacemos nuestra vida, en nuestras células se producen millones de reacciones bioquímicas. Entre el ajetreo de los intercambios químicos se encuentran los que adhieren (o retiran) pequeñas moléculas de carbono a las proteínas, las grasas y el ADN, entre otros. Añadir o quitar estas pequeñas moléculas es esencial para muchas reacciones que permiten a las células sobrevivir, crecer y dividirse.
Cada segundo que respiramos, dormimos, comemos y hacemos nuestra vida, en nuestras células se producen millones de reacciones bioquímicas. Entre el ajetreo de los intercambios químicos se encuentran los que adhieren (o retiran) pequeñas moléculas de carbono a las proteínas, las grasas y el ADN, entre otros. Añadir o quitar estas pequeñas moléculas es esencial para muchas reacciones que permiten a las células sobrevivir, crecer y dividirse.Quizá el objetivo más interesante y estudiado de estas adiciones y sustracciones se encuentre en el bullicioso núcleo, donde varias enzimas añaden o eliminan dos pequeñas moléculas —grupos metilo y grupos acetilo— en las histonas, las bobinas de proteína alrededor de las cuales se enrolla nuestro ADN.
Durante décadas, se pensó que añadir o eliminar grupos metilo o acetilo de las histonas era clave para determinar cuándo y dónde se activan los genes.
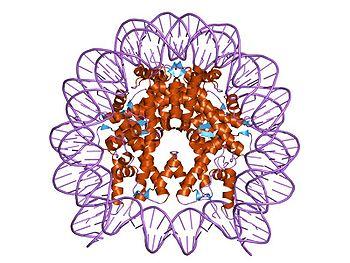 Pero cada vez hay más pruebas de que esto es solo una parte de la historia. Aunque añadir grupos metilo y acetilo a las histonas está estrechamente relacionado con la actividad de genes cercanos en algunos lugares del genoma, en muchas otras regiones no tiene ningún efecto. Esto sugiere que regular la actividad de los genes no es la única función de estos adornos de las histonas —quizá ni siquiera la principal—.De hecho, las nuevas investigaciones sugieren que estas modificaciones de las histonas desempeñan papeles clave en los procesos bioquímicos de la célula — su metabolismo—, funcionando como una forma de que la célula se ocupe de las pequeñas moléculas de carbono que se producen durante las reacciones bioquímicas.
Pero cada vez hay más pruebas de que esto es solo una parte de la historia. Aunque añadir grupos metilo y acetilo a las histonas está estrechamente relacionado con la actividad de genes cercanos en algunos lugares del genoma, en muchas otras regiones no tiene ningún efecto. Esto sugiere que regular la actividad de los genes no es la única función de estos adornos de las histonas —quizá ni siquiera la principal—.De hecho, las nuevas investigaciones sugieren que estas modificaciones de las histonas desempeñan papeles clave en los procesos bioquímicos de la célula — su metabolismo—, funcionando como una forma de que la célula se ocupe de las pequeñas moléculas de carbono que se producen durante las reacciones bioquímicas.Los investigadores proponen que, en el caso de los grupos acetilo (formados por dos carbonos, tres hidrógenos y un oxígeno), las histonas sirven como una especie de banco o repositorio al que la célula puede recurrir cuando necesita más acetilos para las reacciones químicas.
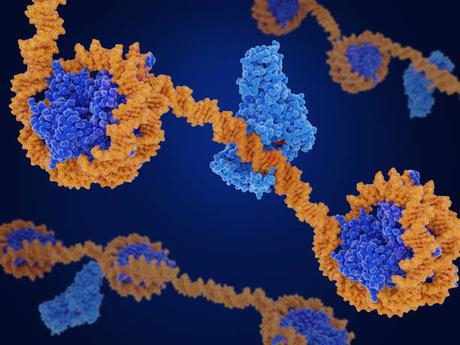 Y en el caso de los grupos metilo (un átomo de carbono y tres hidrógenos), sugieren que las histonas sirven como sumideros, donde se pueden depositar los metilos para que no entorpezcan las reacciones químicas. Sin este sumidero, muchas moléculas que necesitan perder un grupo metilo para pasar al siguiente paso de una ruta bioquímica se atascan, causando problemas a la célula.
Y en el caso de los grupos metilo (un átomo de carbono y tres hidrógenos), sugieren que las histonas sirven como sumideros, donde se pueden depositar los metilos para que no entorpezcan las reacciones químicas. Sin este sumidero, muchas moléculas que necesitan perder un grupo metilo para pasar al siguiente paso de una ruta bioquímica se atascan, causando problemas a la célula.Antes se consideraba que las histonas eran un mero andamiaje estructural para los genes: algo que podía mantener en orden los densos pliegues de cadenas de ADN. Luego se consideró que intervenían en el control de los genes — facilitando o bloqueando el desdoblamiento del ADN que permite que se copie—. Ahora, si la nueva investigación da sus frutos, también se demostrará que están profundamente entrelazadas con el funcionamiento metabólico de las células.
Según los científicos, esto podría ayudar a desvelar cómo y por qué evolucionaron las histonas.
Las células necesitan lugares donde depositar los grupos metilo —un sumidero de metilo— para que el metabolismo no se atasque.
Tiempos de abundancia
 Hace más de una década, Benjamin Tu, bioquímico de la UT Southwestern, cultivaba células de levadura en su laboratorio cuando vio algo interesante: la actividad de más de mil genes oscilaba en función de la cantidad de oxígeno que consumían las células. La actividad de los genes y la actividad metabólica cambiaban de forma coordinada.
Hace más de una década, Benjamin Tu, bioquímico de la UT Southwestern, cultivaba células de levadura en su laboratorio cuando vio algo interesante: la actividad de más de mil genes oscilaba en función de la cantidad de oxígeno que consumían las células. La actividad de los genes y la actividad metabólica cambiaban de forma coordinada.Tu también observó que cuando los genes implicados en el crecimiento celular alcanzaban su máxima actividad, esto coincidía con un elevado número de grupos acetilo adheridos a sus histonas. Y cuando los genes se silenciaban en la siguiente fase del ciclo celular, los grupos acetilo desaparecían. “Fue muy emocionante”, afirma Tu.
Fue emocionante porque los grupos acetilo son producidos por la mitocondria, el orgánulo generador de energía de la célula. La célula utiliza los grupos acetilo para producir moléculas como los ácidos grasos, que se emplean como fuente de energía o para construir las membranas celulares. Lo que parecía estar ocurriendo era que los acetilos servían de señal de la mitocondria al núcleo celular de que eran tiempos de abundancia, con mucha energía y bloques de construcción químicos disponibles. Al adherirse a las histonas, aumentaban la actividad de los genes implicados en el crecimiento celular. Después de todo, tiene sentido crecer y dividirse en épocas de abundancia.
Tu también vio indicios de que los acetilos de las histonas también podían actuar como un banco — una fuente de energía a la que la célula podía recurrir en épocas de vacas flacas—. Observó que, cuando las células pasaban hambre, disminuía la cantidad de una importante sustancia química llamada acetil-CoA, fundamental en la generación de energía. Para producir energía, las células consumían los grupos acetilo que se habían desprendido de las histonas. Los grupos acetilo que quedaban se reorganizaban para activar genes que produjeran más acetil-CoA.Esta ilustración muestra un modelo del movimiento de los grupos acetilo en diferentes condiciones celulares.
 Otros trabajos del grupo de Tu sugieren que las histonas pueden desempeñar un papel aún más central en las rutas metabólicas, esta vez en relación con los grupos metilo. De nuevo en la levadura, los científicos estudiaron una sustancia química que transporta grupos metilo, cuyo nombre abreviado es SAM. Cuando la SAM cede un grupo metilo, se convierte en una sustancia química necesaria para producir el aminoácido cisteína. Pero cuando la célula no tiene un lugar al que ceder sus grupos metilo, se produce muy poca cisteína, lo que afecta a la capacidad de crecimiento de la célula. Las histonas actúan como receptoras de grupos metilo.
Otros trabajos del grupo de Tu sugieren que las histonas pueden desempeñar un papel aún más central en las rutas metabólicas, esta vez en relación con los grupos metilo. De nuevo en la levadura, los científicos estudiaron una sustancia química que transporta grupos metilo, cuyo nombre abreviado es SAM. Cuando la SAM cede un grupo metilo, se convierte en una sustancia química necesaria para producir el aminoácido cisteína. Pero cuando la célula no tiene un lugar al que ceder sus grupos metilo, se produce muy poca cisteína, lo que afecta a la capacidad de crecimiento de la célula. Las histonas actúan como receptoras de grupos metilo.Mantener el metabolismo en marcha
 Más pruebas de la función metabólica de las histonas provienen de un estudio de 2023 en el que el bioquímico de la Universidad de Oxford Peter Sarkies y su colega Marcos Francisco Pérez examinaron toda una serie de enzimas diferentes que añaden grupos metilo a las histonas.
Más pruebas de la función metabólica de las histonas provienen de un estudio de 2023 en el que el bioquímico de la Universidad de Oxford Peter Sarkies y su colega Marcos Francisco Pérez examinaron toda una serie de enzimas diferentes que añaden grupos metilo a las histonas.Cada enzima añade grupos metilo en un lugar único de la histona, una parte flexible llamada cola de la histona. Dependiendo de dónde se añadan los metilos, el efecto puede asociarse a una actividad génica activada, a una actividad génica suprimida o a ningún cambio en absoluto. Sarkies razonó que, si lo que se pretende es eliminar los grupos metilo para que el metabolismo pueda seguir su curso, lo que importa es la suma de la actividad de todas estas enzimas —y no la de una enzima concreta o un efecto particular sobre un gen cercano—.
Esto es exactamente lo que observó su equipo cuando examinó varias líneas celulares de cáncer. Cada línea celular había elevado o reducido la actividad de distintas combinaciones de esas enzimas metilantes, de modo que podían depositar grupos metilo en las histonas para apartarlas y mantener el metabolismo a buen ritmo.
 Los científicos también descubrieron que muchas de las enzimas metilantes estaban bajo la influencia de un gen llamado Rb, conocido por su papel en la supresión del cáncer (suele estar mutado en las células cancerosas). Esto sugirió a Sarkies que Rb desempeña un papel central en el aumento o la disminución de la velocidad a la que se depositan los grupos metilo en las histonas y, por tanto, en la regulación de las vías bioquímicas y el crecimiento.
Los científicos también descubrieron que muchas de las enzimas metilantes estaban bajo la influencia de un gen llamado Rb, conocido por su papel en la supresión del cáncer (suele estar mutado en las células cancerosas). Esto sugirió a Sarkies que Rb desempeña un papel central en el aumento o la disminución de la velocidad a la que se depositan los grupos metilo en las histonas y, por tanto, en la regulación de las vías bioquímicas y el crecimiento.“Lo que descubrimos es que la célula utiliza la metilación de las histonas no solo para regular los genes, sino también el metabolismo”, afirma Sarkies.
Más posibilidades
Los investigadores también han aprendido recientemente que las histonas a veces pueden implicarse en otros aspectos de la bioquímica celular. En un estudio publicado en 2017, el equipo del biólogo de la cromatina Marcus Buschbeck, del Instituto de Investigación contra la Leucemia Josep Carreras de Barcelona, demostró que un tipo de histona llamada macroH2A1.1 puede ayudar a preservar una sustancia química llamada NAD+, que es esencial en muchas reacciones bioquímicas. Esto deja más NAD+ a disposición de las mitocondrias generadoras de energía.
El equipo del bioquímico Siavash Kurdistani, de la Universidad de California en Los Ángeles, demostró en 2020 que las histonas funcionan como enzimas que convierten los iones de cobre oxidados (Cu2+) en iones de cobre reducidos (Cu1+). Los iones de cobre reducidos son la forma que necesita la mitocondria para producir energía. Estos iones habrían sido difíciles de conseguir en los albores de la evolución de las células eucariotas complejas, como la nuestra, porque el cobre se oxidaba a medida que aumentaban los niveles de oxígeno en la atmósfera.
A medida que descubren este vínculo entre histonas y metabolismo, los investigadores también especulan sobre cómo surgió la relación.
 Observan que en los microbios llamados arqueas — a partir de los cuales se cree que evolucionaron las células eucariotas— existe una gran variedad de histonas. Pero muy pocas de ellas tienen las colas flexibles que tienen nuestras propias histonas, en las que se colocan las marcas de metilo y acetilo. Por eso, los científicos están interesados en saber cómo funcionaban las histonas en nuestros antepasados arqueas.La mayoría de las histonas de las formas de vida unicelulares llamadas arqueas no tienen cola o tienen una cola corta.
Observan que en los microbios llamados arqueas — a partir de los cuales se cree que evolucionaron las células eucariotas— existe una gran variedad de histonas. Pero muy pocas de ellas tienen las colas flexibles que tienen nuestras propias histonas, en las que se colocan las marcas de metilo y acetilo. Por eso, los científicos están interesados en saber cómo funcionaban las histonas en nuestros antepasados arqueas.La mayoría de las histonas de las formas de vida unicelulares llamadas arqueas no tienen cola o tienen una cola corta.Se barajan diversas posibilidades. Kurdistani sugiere que el primer papel de las histonas arqueas podría haber sido producir esos preciados iones de cobre reducidos. El biólogo de la cromatina Tobias Warnecke, del Imperial College de Londres, que estudia la evolución de las histonas en las arqueas, sugiere que las histonas arqueas podrían ayudar a evitar que el ADN se rompiera en los entornos extremos en los que viven las arqueas, como el calor intenso. Las histonas también podrían haber protegido el ADN de las arqueas de los virus que intentaban insertarse en él, añade Warnecke.
Más tarde, tras la aparición del ancestro de los eucariotas actuales hace unos 1.500 millones de años, las histonas evolucionaron hacia colas más largas que se modificaron químicamente de diversas formas, entre ellas con grupos acetilo y metilo. Según Tu, es posible que tales modificaciones surgieran para gestionar los metabolitos producidos por las mitocondrias en aquellos primeros eucariotas. Algunas sustancias químicas producidas en las mitocondrias son muy reactivas y podrían adherirse espontáneamente — y dañar— moléculas importantes como el ADN. Tal vez la célula desarrolló enzimas para eliminar estas pequeñas moléculas de carbono de los lugares donde podrían ser perjudiciales y pegarlas en su lugar en lugares como las colas de las histonas, donde no causarían ningún daño.
Más tarde, la célula podría haber pasado a depender de estas modificaciones de las histonas para su regulación metabólica.
¿Y más tarde aún? La historia de la evolución de las histonas parece ser una historia de reutilización. Si las células se toparon primero con una forma de regular su metabolismo con histonas, dice Sarkies, un proceso similar podría haber llevado a utilizarlas para controlar los genes. En el caso de las histonas, sugiere, “la regulación metabólica es más fundamental que la regulación génica”.

