Hoy en día numerosos estudios genómicos, filogenéticos, análisis epidemiológicos, diagnóstico clínico, medicina forense y muchos de los procedimientos de la biología molecular moderna dependen de la amplificación de cantidades limitantes de DNA, siendo un prerrequisito para un análisis genómico exitoso la disponibilidad de herramientas para la amplificación eficiente de secuencias de ácidos nucleicos.
Si bien la reacción en cadena de la polimerasa (PCR) es aún la metodología más utilizada en la amplificación de DNA, ésta depende de un conocimiento previo de las secuencias a amplificar, y genera amplicones relativamente pequeños. Muchos análisis genómicos dependen no solo de la longitud del material amplificado, sino también de una amplificación homogénea, por lo que son más ventajosas aquellas metodologías que permiten la amplificación eficiente y representativa de genomas completos, siendo la amplificación isotérmica por desplazamiento múltiple (MDA) la que está ganando terreno en el área de la amplificación de DNA. La MDA se lleva a cabo utilizando oligonucleótidos hexaméricos de secuencia al azar que hibridan en distintas regiones del genoma a amplificar y que son extendidos posteriormente por la DNA polimerasa (enzima que sintetiza DNA) del bacteriófago ø29, en una reacción isotérmica a 30 ºC, sin que se requieran ciclos de desnaturalización/renaturalización (a diferencia de la PCR), ni de un conocimiento previo de la secuencia (Figura 1). El éxito de MDA radica en las características intrínsecas y específicas de la DNA polimerasa de ø29:
1) Capacidad de polimerizar más de 100.000 nucleótidos (las unidades que se ensamblan para construir el DNA) sin disociarse del DNA.
2) Capacidad de atravesar regiones de doble cadena ya que el enzima acopla la síntesis del DNA a la apertura (desnaturalización) de las dos cadenas del DNA, haciendo innecesarios ciclos térmicos de desnaturalización.
3) Elevada fidelidad de síntesis del DNA (sólo un error cada 108-109 nucleótidos incorporados).
Esta metodología de amplificación se ha mostrado muy eficiente como paso previo a la secuenciación, para la caracterización de genomas virales desconocidos, para el genotipado de polimorfismos de nucleótido único, y recientemente para la descripción de nuevos metagenomas.
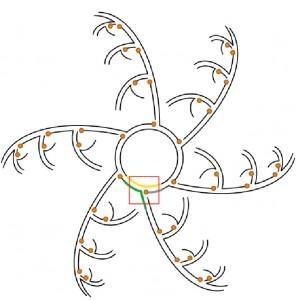
Figura 1
Figura 1. Amplificación por desplazamiento múltiple con la DNA polimerasa de ø29. La DNA polimerasa (en esferas naranjas) puede comenzar simultáneamente la síntesis del DNA en múltiples sitios a los que se han hibridado al azar los hexámeros. Una vez alcanzado el hexámero que se encuentra delante, la síntesis continúa ya que la polimerasa abre esa región de cadena doble, dando lugar a “ramas” de cadena sencilla a las cuales se unirán nuevos hexámeros. Esta síntesis continua del DNA dará lugar a una amplificación isotérmica y exponencial del DNA.
Puesto que MDA es una alternativa más versátil y prometedora que PCR, el principal reto era la construcción de variantes de la DNA polimerasa de ø29 aún más eficientes en amplificación de DNA. Debido a la complejidad estructural de las DNA polimerasas y a sus múltiples interacciones con los sustratos, la adquisición de nuevas propiedades requiere de grandes modificaciones estructurales, tarea difícil de abordar con mutaciones puntuales dirigidas a aminoácidos específicos. De hecho, hasta la fecha, las únicas mejoras en MDA se habían conseguido explorando diferentes modificaciones técnicas de los protocolos actuales.
En el trabajo publicado recientemente en la revista Proceedings of the National Academy of Sciences of USA los doctores Miguel de Vega y Margarita Salas, del Centro de Biología Molecular Severo Ochoa (CSIC-UAM), se plantearon como objetivo conseguir variantes de la DNA polimerasa de ø29 que mostraran más afinidad por el DNA a amplificar que el enzima no modificado con el fin de aumentar la eficiencia de amplificación. Mediante técnicas de ingeniería de proteínas fusionaron al extremo C-terminal de la DNA polimerasa de ø29 dominios de unión inespecífica al DNA (Helix-hairpin-Helix; HhH) (Figura 2). Las DNA polimerasas quiméricas resultantes mostraron un incremento, respecto al enzima natural, en la capacidad de utilización de los hexámeros iniciadores, implicando una mayor eficiencia de amplificación (vía MDA) de cantidades limitantes de DNA, tanto circular como genómico lineal, lo que representa una mejora sustancial en los protocolos de amplificación. Estas variantes de la DNA polimerasa de ø29 tienen aplicaciones potenciales en análisis genómicos, como estudios clínicos, forenses y antropológicos en los que las cantidades muy limitantes de DNA suponen una barrera para su amplificación y posterior estudio. Además, la alta fidelidad de inserción de nucleótidos y elevada procesividad de estas quimeras hace que puedan ser útiles en las tecnologías de secuenciación de tercera generación que actualmente se están desarrollando. La combinación de las DNA polimerasas quiméricas con la optimización de los protocolos de reacción actuales contribuirán a hacer de las tecnologías de amplificación basadas en la DNA polimerasa de ø29 una de las herramientas más potentes en genómica.
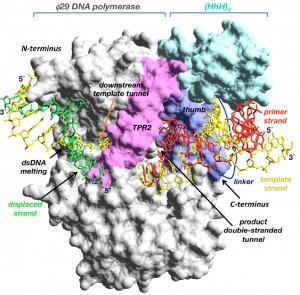
- Figura 2
Figura 2. Modelado de las DNA polimerasas quiméricas construidas. La figura representa el modelo estructural de un dominio (HhH)2 (en azul claro) unido a través de un péptido de unión al extremo C-terminal de la DNA polimerasa de ø29 (en morado)El interés biotecnológico de estas variantes creadas por ingeniería de proteínas ha quedado refrendado por la reciente concesión de la licencia de explotación de estas polimerasas por parte del CSIC a la empresa española de biotecnología XPol Biotech, SL para su pronta puesta en el mercado.
Este trabajo ha merecido una reseña en la revista Science-Business eXchange, del grupo Nature.
CBMSO
DIVULGACIÓN CIENTÍFICA A 7 DE FEBRERO DE 2011
MADRI+D TV (Divulgación científica con cara, e imágenes, en 3 minutos)
ENTRE PROBETAS (Píldoras científicas en 2 minutos). Radio 5
A HOMBROS DE GIGANTES Radio 5
FACEBOOK (José Antonio López-Guerrero)
TWITTER (JALGUERRERO)
LINKED-IN (Jal Guerrero)
