¿QUÉ ES EL CALCIO?
 El calcio es el elemento químico de número atómico 20, lo que significa que cuenta con 20 protones en su núcleo atómico. En la tabla periódica está situado en el grupo 2 con los metales alcalinotérreos y en el periodo 4. Se trata de un elemento muy reactivo, por lo que no se encuentra en su forma pura en la naturaleza, si no formando parte de rocas y minerales. Su nombre proviene del latín calx o cal, un producto mineral muy utilizado en construcción que se obtiene al calentar la roca caliza a altas temperaturas.
El calcio es el elemento químico de número atómico 20, lo que significa que cuenta con 20 protones en su núcleo atómico. En la tabla periódica está situado en el grupo 2 con los metales alcalinotérreos y en el periodo 4. Se trata de un elemento muy reactivo, por lo que no se encuentra en su forma pura en la naturaleza, si no formando parte de rocas y minerales. Su nombre proviene del latín calx o cal, un producto mineral muy utilizado en construcción que se obtiene al calentar la roca caliza a altas temperaturas.Se trata de un elemento relativamente blando (se puede cortar con un cuchillo con dificultad) y de brillo metálico, pero que se oxida rápidamente con los gases atmosféricos y queda recubierto con una película oscura. En cuanto a su presencia, el calcio es el quinto elemento más abundante en la corteza terrestre, y conforma aproximadamente un 4,1% del total de su peso. La configuración más habitual de encontrar el calcio es en forma de carbonatos, bien sean de origen mineral, o de origen biológico, como pueden ser los restos de caparazones de la especies marinas.
Los restos más antiguos del uso de la cal provienen de algunos de los primeros asentamientos reconocidos de forma oficial, hace entre 7500 y 6000 años. Normalmente, este material de construcción se empleaba como aglutinante en la construcción y, debido a sus propiedades desinfectantes, como revestimiento o enlucido de paredes. También se ha Sin embargo, no fue hasta 1808 que el químico francés Humphry Davy consiguió aislar el elemento puro mediante la electrólisis del óxido de calcio.
PROPIEDADES QUÍMICAS DEL CALCIO (CA)
 · El átomo de calcio tiene una configuración electrónica [Ar] 4s², es decir, que tiene la misma configuración electrónica que el gas noble argón excepto por su capa más externa, donde presenta dos electrones extra.
· El átomo de calcio tiene una configuración electrónica [Ar] 4s², es decir, que tiene la misma configuración electrónica que el gas noble argón excepto por su capa más externa, donde presenta dos electrones extra.· El calcio tiene una electronegatividad de 1 en la escala de Pauling, por lo que tiende a perder los dos electrones de su capa más externa y a formar compuestos.
· Su masa atómica es de 40,08 g/mol y su densidad es de 1,52 g/ml
· El calcio no se encuentra en la naturaleza en su forma pura, si no que se une a otros elementos para formar minerales y rocas. Generalmente se puede encontrar con carbono, formando carbonatos, con azufre (sulfatos), con fósforo (fosfatos) o con oxígeno e hidrógeno (hidróxido de calcio) aunque son los únicos.
· Cuando se extrae en su forma pura, el calcio tiene un brillo metálico. Reacciona rápidamente con los gases del aire, formando una película oscura.
· A presión ambiente, el calcio pasa a estado líquido a los 842°C y ebulle a los 1494°C
· Hay 5 isótopos estables de calcio: Ca⁴⁰ (el más común, 96,94% del calcio total), Ca⁴², Ca⁴³, Ca⁴⁴ y Ca⁴⁶; aunque el isótopo radiactivo Ca⁴⁸ también se suele considerar estable, ya que tiene una semivida de 4,3x 10¹⁹ años. Existen otros muchos isótopos de calcio entre Ca³⁵ y Ca⁶⁰.
· El calcio es el quinto elemento más abundante en la corteza terrestre (aproximadamente un 3,5% del total). En los seres vivos es el metal más abundante y forma parte de una gran cantidad de procesos.
· Su nombre proviene del latín calx, (cal) un material conocido desde la antigüedad formado por óxido e hidróxido de calcio que se obtenía al calentar calcita.
EFECTOS SOBRE LA SALUD DEL CALCIO
El calcio es el metal más abundante del cuerpo humano, y es vital para un sinfín de procesos biológicos, desde el movimiento de los músculos, hasta los neurotransmisores. Por ello, este elemento se almacena principalmente en los huesos y en los dientes, donde también cumple una función estructural. Para evitar problemas de salud, los adultos han de consumir aproximadamente un gramo de calcio al día, aunque esta cifra varía enormemente dependiendo de la edad. A partir de los 30-35 años, los huesos pierden calcio progresivamente, por lo que se recomienda aumentar ligeramente la ingesta. Otros elementos, como el magnesio y el manganeso, ayudan a la absorción de calcio en el intestino.
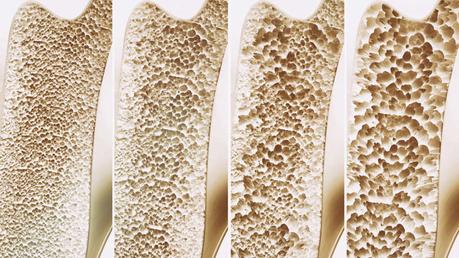
De izquierda a derecha se observa la progresión de la osteoporosis, lo que le da fragilidad al hueso.
Los alimentos que más calcio contienen son los derivados lácteos, como los quesos, que pueden llegar a contener más de 500 miligramos de calcio por 100 gramos de producto. Tras ellos, ciertos tipos de pescados que se consumen con espinas, como las sardinas en conserva, pueden alcanzar los 400 mg por 100 gramos de producto. Los frutos secos como las almendras y avellanas, ciertos mariscos como las gambas se estima que contienen alrededor de 200 mg por 100 gramos de producto, y ciertas legumbres, como los garbanzos, alrededor de 150 mg.
 En caso de una deficiencia de calcio en la infancia provoca detención del crecimiento, y en la adultez aumenta el riesgo de sufrir osteoporosis, raquitismo, u osteomalacia, enfermedades que provocan debilidad y fragilidad en los huesos. Por otro lado, ciertos estudios asocian consumir más de 3 veces la cantidad diaria recomendada de calcio con la aparición de algunos tipos específicos de cáncer de próstata. Existe la creencia popular de que el consumo de lo que se conocen como “aguas duras” (agua potable rica en calcio o magnesio) puede formar cálculos renales, conocidas como piedras en el riñón. Sin embargo, esta creencia ha resultado ser falsa. Según un estudio realizado por la Asociación Americana de Urología, el consumo de aguas duras previene la formación de cálculos cálcicos renales.
En caso de una deficiencia de calcio en la infancia provoca detención del crecimiento, y en la adultez aumenta el riesgo de sufrir osteoporosis, raquitismo, u osteomalacia, enfermedades que provocan debilidad y fragilidad en los huesos. Por otro lado, ciertos estudios asocian consumir más de 3 veces la cantidad diaria recomendada de calcio con la aparición de algunos tipos específicos de cáncer de próstata. Existe la creencia popular de que el consumo de lo que se conocen como “aguas duras” (agua potable rica en calcio o magnesio) puede formar cálculos renales, conocidas como piedras en el riñón. Sin embargo, esta creencia ha resultado ser falsa. Según un estudio realizado por la Asociación Americana de Urología, el consumo de aguas duras previene la formación de cálculos cálcicos renales.EFECTOS AMBIENTALES DEL CALCIO
 El calcio en estado puro se utiliza en tan poca cantidad que no se han observado efectos nocivos para el medio ambiente. Sin embargo, la extracción y procesado de algunos de sus compuestos empleados en construcción, como los mármoles, alabastro, roca caliza, o yeso emplean procesos que sí que pueden ser altamente contaminantes. Para suplir la demanda mundial de estos materiales se horadan enormes canteras que modifican profundamente el terreno. Las explotaciones mineras emplean maquinaria pesada o explosivos para romper la roca y, posteriormente llevarla a los lugares de construcción o a las plantas de refinado. Estas prácticas tienen un enorme impacto en los ecosistemas circundantes.
El calcio en estado puro se utiliza en tan poca cantidad que no se han observado efectos nocivos para el medio ambiente. Sin embargo, la extracción y procesado de algunos de sus compuestos empleados en construcción, como los mármoles, alabastro, roca caliza, o yeso emplean procesos que sí que pueden ser altamente contaminantes. Para suplir la demanda mundial de estos materiales se horadan enormes canteras que modifican profundamente el terreno. Las explotaciones mineras emplean maquinaria pesada o explosivos para romper la roca y, posteriormente llevarla a los lugares de construcción o a las plantas de refinado. Estas prácticas tienen un enorme impacto en los ecosistemas circundantes. Aunque sin duda, uno de los procesos más contaminantes para el medio ambiente es la calcinación de la cal. Para obtener este preciado material se necesitan hornos que superen una temperatura de 1000°C, por lo que han de ser alimentados con la quema de combustibles fósiles y/o biomasa. Además, durante el proceso se expulsan a la atmósfera contaminantes como partículas, monóxido de carbono, óxidos de nitrógeno, dióxido de azufre o los ácidos clorhídrico y fluorhídrico. Estos gases pueden empobrecer la calidad del aire circundante y provocar episodios de lluvia ácida si no se disipan en la atmósfera.
Aunque sin duda, uno de los procesos más contaminantes para el medio ambiente es la calcinación de la cal. Para obtener este preciado material se necesitan hornos que superen una temperatura de 1000°C, por lo que han de ser alimentados con la quema de combustibles fósiles y/o biomasa. Además, durante el proceso se expulsan a la atmósfera contaminantes como partículas, monóxido de carbono, óxidos de nitrógeno, dióxido de azufre o los ácidos clorhídrico y fluorhídrico. Estos gases pueden empobrecer la calidad del aire circundante y provocar episodios de lluvia ácida si no se disipan en la atmósfera.

