Hace unos meses publiqué en este mismo blog una entrada titulada "En búsqueda de la superxilanasa". En ella os explicaba nuestro papel en el proyecto WoodZymes. Un proyecto europeo basado en la bioeconomía sostenible en el contexto de la madera y la pulpa de papel. El objetivo del proyecto es encontrar nuevos usos a los subproductos de esta industria y sustituir la química tradicional por una química más sostenible, basada en el uso de enzimas. Tras el estudio de otra familia de xilanasas, la GH10, se ha encontrado una xilanasa, que no sabemos si es la superxilanasa "definitiva" pero apunta maneras...La xilanasa 11, Xyn11 para los amigos, es fruto de un estudio bioinformático de más de 2300 secuencias que aparecían anotadas en las bases de datos. Este trabajo ha sido desarrollado por el grupo de Estructura y Función de Enzimas, liderado por Julio Polaina, del Instituto de Agroquímica y Tecnología de los Alimentos (CSIC). En la actualidad, el abaratamiento en los costes de secuenciación hace que los resultados generados en estos estudios superen en varios órdenes de magnitud las secuencias que son caracterizadas en el laboratorio, y por tanto analizadas de forma experimental. La gran mayoría de secuencias de genes que aparecen en las bases de datos anotadas como xilanasas, lactasas, etc, son asignadas por homología de secuencia, pero menos de un 1% han sido analizadas bioquímicamente. Es por ello que estas bases de datos son un buen punto de partida para "minar" nuevos enzimas.El gran problema de los enzimas de interés industrial es que deben cumplir ciertas características muy particulares, en este caso capacidad para trabajar a 90ºC y condiciones de alcalinidad pH > 8. Son condiciones muy extremas, pero no imposibles, de echo hay organismos que viven en ecosistemas tanto o mas extremos. Es poco práctico llevar a la bancada del laboratorio miles de secuencias para su caracterización, así que un buen cribado previo, usando herramientas bioinformáticas, puede ayudar a acotar qué secuencias candidatas podrían tener las características deseadas.En este caso se ha logrado ordenar y clasificar en un inmenso cladograma las distintas secuencias de la familia a partir del alineamiento del dominio catalítico GH10 que caracteriza a la familia. De esta forma se ha acotado una región del cladograma que pudiese contener secuencias correspondientes a xilanasas termófilas y alcalófilas.
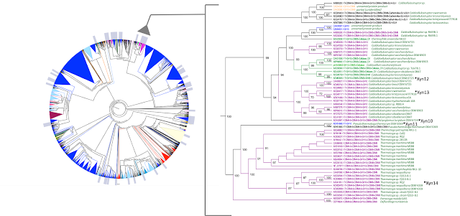
Estudio bioinformático de la familia GH10
De esta región se escogieron cinco secuencias cuyo código genético se optimizó para la producción de la proteína en E. coli y las proteínas resultantes se caracterizaron bioquímicamente mediante ensayos de actividad a distintas condiciones de pH y temperatura.Entre estas secuencias apareció una que, si no es la "superxilanasa" definitiva, es candidata a serlo, ya que es activa a 90ºC y pH10.5, la Xyn11 de Pseudothermotoga thermarum. Además, mediante la adición de dominios de unión a carbohidratos, se consiguió incrementar todavía más la actividad a estas condiciones, concretamente mediante la adición del CBM2 de Pyrococcus furiosus que ya ha sido ampliamente ensayado en otros trabajos como dominio de unión a sustratos/soportes como celulosa o quitina. Además, en colaboración con el grupo de cristalografía del Instituto de Química Física Rocasolano (CSIC), liderado por Julia Sanz-Aparicio, se ha resuelto la estructura cristalográfica de Xyn11 para averiguar qué elementos estructurales podrían explicar tan exclusivas propiedades. Al igual que el resto de proteínas, la estructura terciaria viene determinada por puentes de hidrógeno, salinos, interacciones hidrofóbicas, etc. Pero, a diferencia de otras proteínas, la densidad de este tipo de interacciones respecto del tamaño de la proteína parece mayor y esto deriva en una mayor rigidez de la estructura, protegiéndola de la desnaturalización en condiciones extremas.Esta enzima está siendo testada frente a sustratos como la paja de arroz para la obtención de subproductos que pueden ser utilizados como por ejemplo prebióticos, así como para el tratamiento de la pulpa de papel como una alternativa más respetuosa para el medio ambiente. Os dejo con el artículo para aquellos que tengáis interés en leerlo, ya que es OpenAcces:

