La energía libre de Gibbs La energía libre y la segunda ley de la termodinámica Interpretación de la energía libre de Gibbs Energía libre estándar y sus cambios Aplicación de las variables termoquímicas ΔH, ΔS y ΔG Aplicación de las variables termoquímicas ΔH, ΔS y ΔG
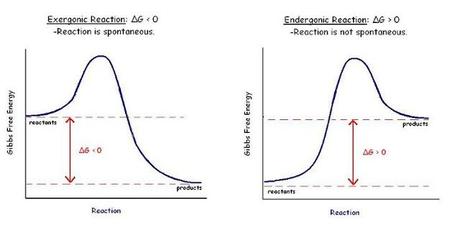
Finalmente podemos determinar la espontaneidad o no espontaneidad de una reacción química. Para ello emplearemos la siguiente ecuación

Recordando que

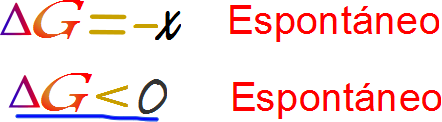
Caso 1. Si la entalpia y la entropía son ambos positivos la reacción dependerá de la temperatura. Evento a A bajas temperaturas el resultado será positivo y por lo tanto la reacción no será espontánea. Esto tienen sentido, una reacción de entalpia positiva es endergónica, requiere energía, incrementar la energía del sistema es algo que debe hacerse incrementando la temperatura. Evento b A altas temperaturas la espontaneidad se invierte si el producto de la temperatura por la entropía supera a la entalpia. Es decir se volverá espontanea con la administración de energía. Caso 2. Si la entalpia es negativa y la entropía es positiva el resultado siempre será negativo, es decir siempre espontáneo sin importar a que temperatura se haga. Caso 3. Si la entalpia es positiva y la entropía negativa el valor siempre dará un resultado positivo. Esto implica que la reacción es imposible de manera radical, y solo su reacción inversa será espontanea siempre. Caso 4. Si la entalpia y la entropía son ambos negativos. En este caso todo dependerá de la temperatura. Evento a A bajas temperaturas el resultado será negativo y por lo tanto la reacción será espontánea. Evento b A altas temperaturas la espontaneidad se invierte si el producto de la temperatura por la entropía supera a la entalpia. Es decir se volverá no espontanea con la administración de energía favoreciéndose la reacción inversa. Caso 5. Durante los cambios de fase, el cambio en la energía libre se hace 0 y el sistema entra en equilibrio. En tal caso la entalpia será igual con signo inverso al valor del producto de la entropía por la temperatura.
PRINCIPAL REGRESAR
