Este nombre está asociado a las enfermedades consideradas como ‘raras’ o poco frecuentes.
La salud, como todos sabemos, es un negocio… Nos guste o no, eso es así…
La investigación y el desarrollo de la medicación que tomamos está financiada por laboratorios farmacéuticos, que son los que ponen el dinero que paga los utensilios y productos empleados en los laboratorios y los sueldos de los investigadores entre otras cosas.
Si un laboratorio no ve beneficio en un tratamiento, no lo investiga.
Si un laboratorio no ve beneficio en la investigación de una determinada enfermedad, no centra sus investigaciones en desarrollar tratamientos para esta enfermedad…
Es lo que sucede en el caso de muchas de las enfermedades ‘raras’ o poco frecuentes. Sin embargo, la realidad es que si no fuera por las compañías farmacéuticas, sólo los ricos a los que les ha tocado de algún modo la enfermedad invertirían en investigación. Nadie más lo haría. Por eso, como siempre digo, las farmas pueden no ser el enemigo tal y como las percibimos nosotros… Los gobiernos podrían hacer más esfuerzo e invertir en investigación (y no lo hacen o no lo hacen lo suficiente) y podrían ejercer más presión en el tema de los precios.
Sobre todo, los gobiernos tienen en su mano el que muchos pacientes reciban tratamientos caros y deciden que no los van a recibir. Mi caso con belimumab (mejor no recordarlo porque me da algo!!!!).
¿Qué son los medicamentos huérfanos?
Según las palabras de OrphaNet, los medicamentos huérfanos son aquellos que “están destinados a tratar enfermedades que, por su rareza, los patrocinadores (farmacéuticas o estado) se muestran reacios a desarrollar bajo las condiciones de mercado habituales, ya que el pequeño tamaño del mercado (pacientes) al que van dirigidos no permitiría recuperar el capital invertido en la investigación y en el desarrollo del producto”.

Básicamente, como ya he dicho antes, no resulta rentable invertir en la investigación de la enfermedad con la finalidad de desarrollar medicamentos exclusivos para la misma.
Como ya vimos en el artículo sobre cómo se aprueban los medicamentos, los estudios y procesos a que hay que someter un medicamento para su aprobación y venta son muy costosos. Las compañías farmacéuticas invierten millones y millones es el desarrollo de medicamentos, en ensayos clínicos y en requisitos que se hacen indispensables si quieren que el tratamiento en cuestión sea aprobado para su comercialización en el mundo.
Si un medicamento va a ser aprovechado por menos de 5 de cada 2.000 personas, es imposible que las compañías recuperen el dinero que han invertido. Sólo habría pérdidas.
El resultado de todo esto: no hay medicación ni investigación que se centre en determinadas dolencias. Así es la vida para muchas personas que sólo son… ¿culpables? de padecer una enfermedad poco frecuente mientras que otras, como yo, nos sentimos con “suerte” por tener una enfermedad que sí se investiga al ser más rentable.
¿Cuál es la diferencia entre un medicamento huérfano y otro ‘normal’?
Según la página de EURORDIS, “la designación de huérfano puede ser dada en cualquier etapa de desarrollo del medicamento, siempre que haya una justificación científica apropiada del uso que se le intenta dar a dicho medicamento”. Dicha designación es otorgada por un comité específico de la Agencia Europea del Medicamento (EMEA).
Pero no sólo eso, sino que tras lograr la designación de ‘huérfano’ el medicamento debe ser aprobado para su venta. La designación de huérfano no significa que se pueda vender como tratamiento!!! Así que ojito, vale? Hay dos pasos: designación y aprobación para la venta. Para esto último, ciertos criterios de eficiencia, eficacia y seguridad se deben cumplir.
Productos milagro y medicamentos huérfanos
Como ya me voy conociendo el percal, sé que unos cuantos se van a lanzar a la defensa de productos milagro… Y ante eso sólo tengo que decir: no están aprobados por la EMEA como tratamiento de enfermedades. Los medicamentos huérfanos sí están aprobados por la Agencia Europea del Medicamento (en caso de Europa) y cumplen unos criterios de eficiencia, eficacia y seguridad.
Listado de medicamentos huérfanos
Existe un Registro Comunitario de medicamentos huérfanos que recoge las distintas enfermedades en las que se ha aprobado el uso de determinados medicamentos. En este listado, por ejemplo, encontramos la voclosporina en el tratamiento de la uveítis (que algunos pacientes de lupus tienen).
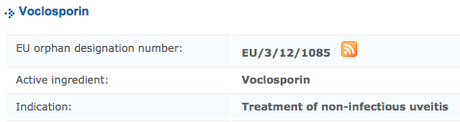
Y, para algunas manifestaciones de lupus eritematoso cutáneo, tenemos una cremita cuyo componente es el sulfato de R-salbutamol. Quizá a algunos nos lo han mandado…

El enlace a este registro lo tenéis en las fuentes.
Disponibilidad de medicamentos huérfanos
A pesar de que hoy día son muchos los medicamentos que han sido aprobados para su uso en el tratamiento de enfermedades poco frecuentes, aún queda mucho por hacer. Muchas personas necesitan tratamientos y que se invierta en el estudio de su enfermedad.
La Unión Europea y EEUU tienen programas que contribuyen a aumentar el listado de estos medicamentos y campañas cuya finalidad es concienciar a la población de la necesidad de investigar e invertir recursos en este tipo de enfermedades.
Esperemos que en un futuro el concepto de “medicamento huérfano” haya pasado a mejor vida.
Porque
Detrás de todo diagnóstico hay una persona. Y toda persona merece un tratamiento específico para SU enfermedadPowered By the Tweet This Plugin
Artículos relacionados:
– Las enfermedades poco frecuentes.
– ¿Son las farmas el enemigo?
– La suerte de tener lupus.
– ¿Quién y cómo se aprueban los medicamentos?
– Los ensayos clínicos.
– La uveítis lúpica.
– Cuidado con lo que vemos en internet! NO a los productos milagro.
Fuentes:
– Orphanet- Sobre los medicamentos huérfanos.
– Federación Española de Enfermedades Raras (FEDER).
– FDA- Programa para las enfermedades poco frecuentes (Inglés).
– EURORDIS- Medicamentos huérfanos (Inglés).
– Instituto de Salud Carlos III- Portal de registro de enfermedades raras.
– Registro Comunitario de medicamentos huérfanos (Inglés).
– Agencia Europea del Medicamento (EMEA): Sulfato de R-salbutamol en pacientes de lupus (Inglés).
Artículos relacionados:
- Quién y cómo se aprueban los medicamentos
- Los medicamentos genéricos
- Medicamentos excluidos de prestación (España, Junio 2012)
- El uso de terapias “off-label”

